Chapitres
Symbole atomique : N Numéro atomique : Z= 7 Principal isotope : A= 14 Structure électronique : (K)2(L)5 Couche externe : L Répartition des électrons externes : trois électrons non appariés et un doublet non liant Nombre de liaisons formées dans une molécule : 3 Configuration électronique : 1s22s22p3 Période : 2 Groupe : 15 Famille : non-métaux Électronégativité : 3,04 Masse molaire atomique : 14,0 g/mol

Origine - étymologie de l'azote
Sous sa forme moléculaire (le diazote), l'azote est le composant majoritaire de l'atmosphère terrestre (78% en volume et 75,5% en masse). Les molécules de diazote sont composées de deux atomes d'azote reliés entre eux par une triple liaison qui les rend très stables, et peu aptes à réagir. Pourtant l'azote est loin d'être inerte, il forme de nombreux composés minéraux (acide nitrique, ammoniac), et surtout il est l'un des éléments essentiels de la chimie organique : il est présent dans la fonction amine et intervient dans les acides aminés qui constituent les protéines.
Le mot "azote" est formé du à partir du mot grec "zoe", qui signifie "vie", associé au préfixe privatif "a" : azote veut donc dire "sans vie". Ce nom a été proposé par Lavoisier, après avoir déterminé que l'air comportait deux constituants dont l'un permet la respiration et donc la vie (le dioxygène), et l'autre non.

La cohérence de ce choix fut par la suite contestée par le chimiste français Jean Antoine Claude Chaptal, pour qui ce terme remettait en cause la nomenclature utilisée pour l'acide nitrique et ses sels : il proposa alors de le rebaptiser "nitrogène". Le terme "azote" est alors conservé en France mais abandonné dans d'autres pays comme en Grande Bretagne qui adopte ce nouveau nom ("nitrogen"). Le symbole atomique de l'azote (N) dérive ce nom. Le terme "azote" est, au vue des connaissances actuelles, encore moins adapté puisque cet élément chimique intervient dans les protéines qui sont des composés biologiques indispensables à la vie humaine, animale et végétale.
Un peu d'histoire : la découverte de l'azote
L'azote est présent dans l'acide nitrique ainsi que dans les sels de nitrate qui sont connus depuis le Moyen-âge. En 1777, le chimiste britannique Henry Cavendish rapporte à son compatriote et confrère Joseph Priestley les résultats d'une expérience réalisée il y a un dizaine d'années. De l'air et du charbon incandescent sont mis en présence l'un de l'autre, puis le gaz obtenu est mis en contact avec une solution basique dans laquelle se dissout l'air fixe (ancien nom du dioxyde de carbone) laissant ainsi un gaz résiduel que Cavendish désigne sous le nom d' « air asphyxiant » ou « air méphitique ». On peut interpréter cette expérience à la lumière des connaissances chimiques actuelles : le charbon, constitué de carbone, brûle en consommant le dioxygène de l'air et en produisant du dioxyde de carbone qui se dissout sous forme d'ions carbonate dans la solution basique. L'air dans lequel s'est déroulé la combustion ne contient plus de dioxygène ni de dioxyde de carbone, il ne reste que le diazote (plus quelques traces d'autres gaz). Cet air irrespirable (car ne contenant pas de dioxygène) peut alors être qualifié d'air asphyxiant. En 1772 Daniel Rutherford, auquel on attribue souvent la découverte du diazote, reproduit cette expérience et rapporte également obtenir un air impropre à la respiration qu'il nomme « air corrompu ». Joseph Priestley la reproduit également à travers plusieurs variantes et propose une interprétation basée sur la phlogistique (théorie chimique expliquant la combustion en postulant l’existence d'un "élément-flamme") mais, comme ses prédécesseurs, il ne voit pas dans "l'air" obtenu un nouveau composé chimique. C'est à Antoine Laurent de Lavoisier que revient ce mérite. Ce dernier se base sur les différentes recherches déjà effectuées et réalise lui-même ses propres expériences à l'aide des matériaux les plus fiables et des instruments les plus précis de son époque. Il désigne d'abord le gaz obtenu sous le nom d'air non respirable, puis propose le nom d'azote.
Les isotopes de l'azote
Isotopes non radioactifs
| Z = 7 - A = 14 | Z = 7 - A = 15 | |
|---|---|---|
| Symbole du noyau | 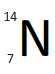 | 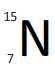 |
| Composition du noyau | 7 protons 7 neutrons | 7 protons 8 neutrons |
| Proportion sur Terre | 99,634 % | 0,366 % |
Radioisotopes naturels
| Z = 7 - A = 13 | |
|---|---|
| Symbole du noyau | 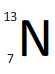 |
| Composition du noyau | 7 protons 6 neutrons |
| Proportion sur Terre | traces |
| Période radioactive | 69,965 min |
| Type de radioactivité | Bêta plus |
Les ions de l'azote
L'azote ne forme pas d'ion monoatomique stable en solution aqueuse, mais au sein de cristaux solides il peut former l'ion nitrure de formule N3- qui possède un excès de 3 électrons.
Il est l'élément principal de plusieurs ions polyatomiques parmi lesquels :
- L'ion nitrate, de formule NO3-
- L'ion ammonium, de formule NH4+ (base conjuguée de l'ammoniac)
- Les bases conjuguées des amines telles que le methylammonium, l’ethylammonium, etc.
Corps simples à base d'azote
Le diazote, de formule N2, est un corps simple constitué de deux atomes d'azote. À pression et température ambiantes il est à l'état gazeux, mais en dessous de -195,79 °C il passe à l'état liquide et peut être utilisé dans un système de refroidissement. Il forme alors ce qu’on appelle de l’azote liquide, notamment utilisé dans le domaine de la recherche pour conserver des tissus biologiques pendant une très longue durée (pouvant aller jusqu’à 10 ans) ou réaliser des expériences nécessitant une faible température. Le diazote est très peu réactif, il est dans des conditions normales insensible à l'eau, aux acides, aux bases et aux halogènes mais il est cependant susceptible de réagir avec le lithium ainsi que les métaux alcalino-terreux tels que le bérylium, le magnésium ou le calcium pour former des nitrures (nitrure de lithium, nitrure de bore, nitrure de magnésium, etc.).
Les corps composés à base d'azote
L'azote peut se combiner avec des atomes d'oxygène pour obtenir des oxydes d'azote gazeux :
- le monoxyde d'azote (NO)
- le dioxyde d'azote (NO2). Il réagit avec l'eau pour donner de l'acide nitrique.
- l'oxyde de diazote ou protoxyde d'azote (N2O), aussi appelé « gaz hilarant » à cause de ses propriétés euphorisantes
- le trioxyde de diazote (N2O3)
- le pentaoxyde de diazote (N2O5)
L'azote intervient dans l'acide nitrique et les sels de nitrate :
- acide nitrique (HNO3)
- nitrate de potassium (KNO3)
- nitrate de sodium (NaNO3)
- nitrate de calcium (Ca(NO3)2)
Utilisation de l'azote dans la vie courante
L’azote au cœur de nos organismes
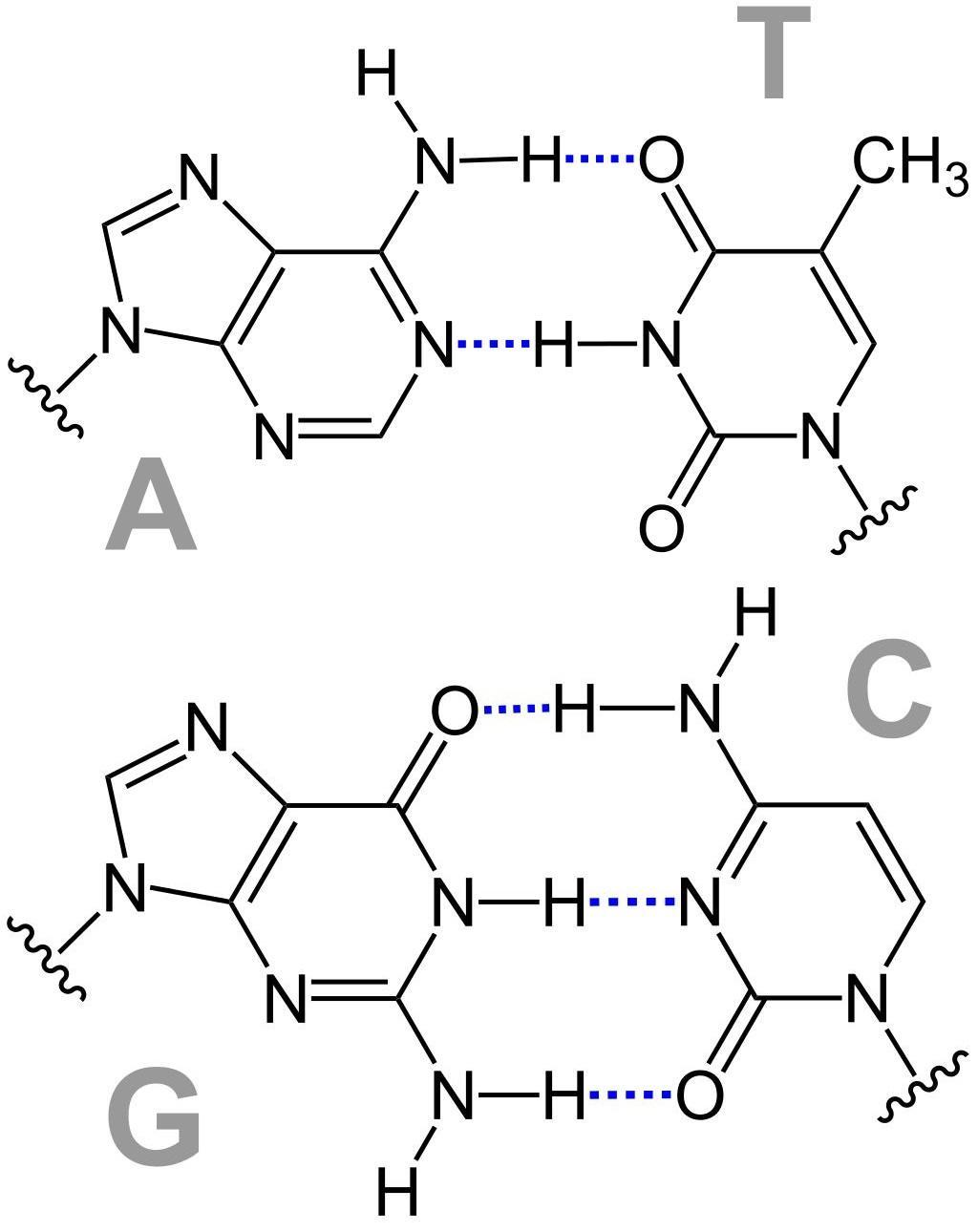
L’azote est l’élément constitutif principal des acides aminés, qui constituent eux-mêmes toutes les protéines du monde vivant. Ces protéines se retrouvent aussi bien dans la structure (on parle alors de protéines structurales) que dans le fonctionnement de nos cellules (avec les protéines de transport ou les enzymes par exemple). Il existe environ 20 acides aminés, dont la combinaison selon une séquence définie par notre ADN permet de réaliser toutes les protéines nécessaires au fonctionnement de notre corps. Les besoins en acides aminés sont très importants chez l’homme, car le corps humain n’est capable de synthétiser que 10 des 20 acides aminés nécessaires à la fabrication des protéines (seulement 9 chez l’enfant). Les acides aminés restants doivent donc être apportés par l’alimentation, à travers les protéines animales comme la viande, les œufs ou le poisson, ou par les protéines végétales comme les légumineuses par exemple. L’Homme ne possédant pas de réserves d’acides aminés, et l’élimination d’azote issus des acides aminés étant constant peu importe l’apport, il est important de conserver un apport régulier et équilibré en acides aminés tous les jours. L’azote est également présent au sein de l’ADN. En effet, l’ADN, pour Acide DesoxyriboNucléique, est composé d’un ose (sucre), d’une molécule d’acide phosphorique et d’une base azotée. Ces bases contiennent plus ou moins d’atomes d’azote selon leur type : les bases puriques, l’adénine A et la guanine G, contiennent 4 atomes d’azote, alors que les bases pyrimidiques, la thymine T et la cytosine C, n’en contiennent que 2. L’association des bases s’effectuent selon une paire purine-pyrimidine : on obtient alors les associations A-T et G-C.
La fertilisation azotée
L’azote est l’un des éléments les plus importants du développement des plantes. On en retrouve par exemple dans la chlorophylle. En effet, l’azote organique absorbé par les racines des plantes peut être métabolisé et minéralisé, à travers un processus microbien, en azote nitrique et azote ammoniacal. Cet azote organique est bien souvent absorbé sous forme d’urée, déchet produit par le foie au cours du cycle de l’urée que nous relâcherons via nos urines par exemple, et qui est actuellement utilisé comme engrais azoté en agriculture. La plante peut également absorber directement de l’azote minéral, qui sera alors plus efficace dans son processus de nutrition. Bien que chaque plante possède des besoins en azote différents, il reste un indispensable à la nutrition de la plante. Les quantités d’azote nécessaires au bon développement d’une plante sont calculées selon un bilan prévisionnel azoté. Un déficit en azote, aussi appelé « faim d’azote », est facilement visible sur une plante : il provoque une chlorose uniforme des végétaux, qui est caractérisée par une décoloration des feuilles due à un manque de chlorophylle. Ce phénomène est accentué par un excès de glucides par rapports aux acides aminés, et peut être mortel pour la plante.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !