Chapitres

Caractérisation de l’aluminium
Aspect et description de l'aluminium
L’aluminium est un élément chimique classé dans le tableau périodique (aussi appelé tableau de Mendeleïev). Il appartient à la famille des métaux pauvres (parfois nommés post-transitionnel ou de post-transition), car les propriétés de ces métaux sont moins prononcées que celles des autres familles de métaux. L’aluminium est un nom dérivé de l’anglais « alumina » provenant du latin alumen signifiant « amer » à cause du goût amer de la pierre d’alun.
L’aluminium pur est un métal malléable de couleur argent, qui présente une faible densité (léger par rapport à son volume) et qui ne s’altère pas (ne s’abîme pas).

Constitution électronique de l'aluminium
Le numéro atomique de l’aluminium étant 13, cela signifie que cet élément chimique dispose de 13 protons, et donc d’autant d’électrons afin d’être électriquement neutre. Il présente également 14 neutrons.
Le symbole de l’aluminium est Al.
Ces 13 électrons sont répartis sur les différentes couches électroniques, de la plus proche du noyau à la plus éloignée, comme suit : (K)2 (L)8 (M)3. 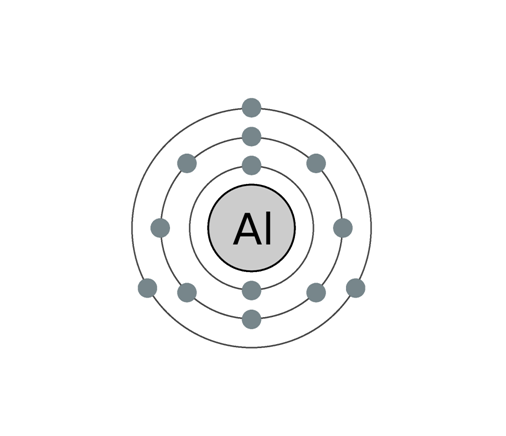
Aluminium et tableau périodique
Le numéro atomique de l’aluminium étant 13, il est positionné dans le tableau périodique entre le magnésium (12) et le silicium (14). L’aluminium fait partie du groupe des métaux pauvres, composés :
- du Zinc (Zn),
- du Gallium (Ga),
- du Cadmium (Cd),
- de l’Indium (In),
- de l’Etain (Sn),
- du Mercure (Hg),
- du Thallium (Tl),
- du Plomb(Pb),
- du Bismuth (Bi),
- du Polonium (Po)
- et du Flévorium (Fl).

Principales caractéristiques de l'aluminium
Dans le tableau ci-dessous sont présentées les principales caractéristiques de l’aluminium.
| Caractéristiques | Données |
|---|---|
| Symbole | Al |
| Numéro atomique | 13 |
| Famille | Métaux pauvres |
| Groupe | 13 |
| Période | 13 |
| Bloc | p |
| Masse volumique | 2,6989 g / cm3 à 20°C |
| Dureté | 1,5 |
| Couleur | Argenté |
| Masse atomique | 27,0 g / mol |
| Rayon atomique | 125 pm environ |
| Configuration électronique | (K)2 (L)8 (M)3 |
| Etat ordinaire | solide |
| Point de fusion | 660,323 °C |
| Point d'ébullition | 2519 °C |
Isotopes
Il existe 22 isotopes connus pour l’aluminium, c’est-à-dire 22 « versions » d’aluminium différentes avec un nombre de masses variables. Les masses correspondent aux neutrons additionnés aux protons. Or le nombre de protons restant fixe (13 pour l’aluminium), c’est donc le nombre de neutrons qui varie d’un isotope à l’autre. Ainsi, il existe les isotopes de 21Al à 42Al. Toutefois, dans la nature, seuls sont présents ceux qui sont stables. Dans le cas de l’aluminium, seul l’isotope 27Al est stable, on dit ainsi que l’aluminium est un élément monoisotopique. Sa demi-vie est de 7,17.105 années.
Seul 27Al est stable et donc présent dans la nature en abondance. Presque tous les autres isotopes ont une demi-vie inférieure à 7 minutes, voire inférieure à une seconde. Ils sont donc présents dans la nature, mais de façon très éphémère : ils disparaissent vite.
- NB : L’isotope 26Al présente également une demi-vie de 7,17.105 années et est également présent dans la nature. Toutefois, il n’est pas stable, contrairement au 27Al.
- Remarque : Le temps de demi-vie est une estimation du temps nécessaire pour que la moitié d’une quantité d’un élément chimique soit désintégrée. Exemple : Si on dispose de 100 atomes de 27Al à T0, on estime qu’il restera 50 atomes dans 7,17.105 années.
Ressources en aluminium et fabrication
Ressources et abondance en aluminium
L’aluminium est un métal abondant sur Terre, c’est même le plus abondant dans l’écorce terrestre. Il représente à peu près 7,4% du poids total de l’écorce terrestre (la partie la plus externe de la planète). En termes d’éléments chimiques, c’est le plus abondant après l’oxygène et le silicium. L’aluminium est rarement présent dans la nature sous sa forme pure car il est trop réactif. C’est pour cela qu’on retrouve l’aluminium combiné à d’autres éléments. La combinaison de l’aluminium avec ces éléments est appelée « minerai ». Afin d’obtenir de l’aluminium pur, il est nécessaire de l’extraire de ces minerais.
Le minerai principal où l’on trouve de l’aluminium est la bauxite. L’aluminium est alors présent sous forme d’oxyde hydraté. On peut extraire de ce minerai de l’alumine.

Extraction de l’aluminium
L’aluminium était initialement considéré comme un métal rare et précieux. Cela s’expliquait par son extraction difficile des minerais, quels qu’ils soient. Aujourd’hui, de nombreux procédés permettent son extraction, faisant de l’aluminium un métal facile à obtenir et donc bien moins coûteux qu’auparavant. Le procédé couramment utilisé à partir de 1886 consiste à extraire de l’alumine dans la bauxite puis à procéder par électrolyse, ce qui correspond à un milieu liquide. NB : L’extraction d’un kilogramme d’aluminium nécessite toutefois de traiter 4 à 5 kg de bauxite et beaucoup d’énergie (souvent produite par les centrales nucléaires). En outre, le procédé d’extraction par électrolyse est à l’origine de rejets de gaz à effet de serre et de certains polluants.
Histoire de l’aluminium
Découverte de l’aluminium
Bien que connu depuis l’Antiquité, l’aluminium n’a été découvert en tant que tel qu’en 1807 par le britannique Humphry Davy. Après avoir découvert le sodium et le potassium, Davy analyse la composition de l’alun et identifie un nouveau métal qu’il nommera « aluminium ». Puis en 1821, le chimiste français Pierre Berthier découvre un minerai composé à plus de 50% d’oxyde d’aluminium. Ce minerai sera baptisé bauxite en raison du lieu de sa découverte à Baux-de-Provence.
Histoire des sciences : la production de l’aluminium
En 1825, le chimiste danois Hans Christian Orsted parvient à produire de l’aluminium via une réaction chimique entre du chlorure d’aluminium et un mélange de mercure et de potassium. Le métal obtenu n’est pas totalement pur mais le procédé apparait alors satisfaisant. En 1827, le chimiste allemand Friedrich Whohler fait mieux que le danois en obtenant de l’aluminium pur. Sa méthode de production permet en outre de déterminer les propriétés physico-chimiques de l’aluminium. Ce n’est qu’en 1854 qu’Henri Deville et Bunsen finissent de mettre au point une nouvelle technique de production de l’aluminium par voie chimique, qui se répand alors à travers toute l’Europe. Le prix de production de l’aluminium équivaut à cette époque à celui de l’or. Très difficile à extraire au départ, l’aluminium était considéré comme un métal précieux. Ce n’est qu’avec les progrès de l’électricité que le procédé d’électrolyse a pu être mis au point et utilisé à partir de 1886 pour l’extraction de l’aluminium associé à une baisse importante des coûts.
Applications de l’aluminium
Propriétés physiques de l'aluminium
L’aluminium est un métal remarquable notamment de par sa légèreté, sa malléabilité (il est mou), sa résistance à la corrosion grâce à la formation d’une couche d’oxydations donnant à l’aluminium sa coloration immuable.
L’aluminium est un très bon conducteur. En revanche, s’il s’oxyde, il perd cette conductivité et devient isolant.
Propriétés chimiques de l'aluminium
Ce métal étant très réactif, cela en fait un bon catalyseur pour certaines réactions chimiques. Il est également reconnu pour augmenter la puissance des explosions au nitrate d’ammonium. NB : Ces propriétés sont à l’origine de l’utilisation de l’aluminium dans les feux d’artifice par exemple, où il remplace le magnésium, ce dernier étant plus onéreux et moins puissant. En solution (en milieu liquide), l’aluminium existe sous la forme d’ions Al3+, il s’oxyde pour former l’alumine Al2O3.
Propriétés biologiques de l'aluminium
Un corps humain à l’âge adulte contient en moyenne 30 à 50 mg d’aluminium, présent dans divers organes tels que les os, les poumons, le foie, etc. Ces quantités évoluent en fonction de l’âge et des organes. En cas d’ingestion d’aluminium, le corps l’élimine naturellement par voie digestive ou par voie urinaire. A faibles doses, la présence d’aluminium dans le corps ne présente pas de risque. A doses plus importantes, l’aluminium est considéré comme toxique et favorisant certaines neuropathies et certains troubles digestifs.
Utilisations et applications de l'aluminium
Les propriétés biologiques de l’aluminium lui valent son utilisation dans les vaccins en tant qu’adjuvant (composant pour renforcer l’effet du vaccin). En effet, l’aluminium stimule le système immunitaire, augmentant ainsi l’efficacité du vaccin administré à un patient. Toutefois, l’équilibre entre bénéfice (meilleure efficacité vaccinale) et risque (toxicité de l’aluminium) est à l’origine d’une grosse polémique depuis plusieurs années. En médecine, l’aluminium est également utilisé dans les dialyses pour équilibre le taux de potassium des patients dialysés. En outre, après le fer, l’aluminium est le métal le plus utilisé, pour ses caractéristiques de légèreté et de conductivité principalement. L’aluminium pur est malléable (mou), mais allier à du cuivre, du manganèse, du magnésium ou encore du silicium, cela en fait des alliages avec des propriétés très variées permettant de une grande variété d’utilisations. 
Effets de l’aluminium
L’aluminium a des effets neurotoxiques de par ses conséquences sur le système nerveux central. Dans les années 70, l’utilisation de l’aluminium lors des dialyses a été à l’origine de ce qui a été appelé « l’encéphalopathie des dialysés », c’est-à-dire d’une démence. Ces mêmes dialyses peuvent également provoquer de l’épilepsie, des troubles de mémoire, ou encore une myofasciite à macrophages (maladie neurologique musculaire). De nos jours, l’utilisation de l’aluminium dans les services de dialyse est très encadré et les risques bien moins importants. Dans la vie courante, l’aluminium est parfois utilisé comme colorant alimentaire (code E173), ainsi que dans les cosmétiques et en particulier dans les déodorants. Cette dernière utilisation est à l’origine d’une polémique car l’aluminium constituerait un facteur de risque supplémentaire pour le développement de cancers du sein.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour. J’aimerai connaitre l’énergie de liaison des couches electroniques de l’aluminium en electronvolt. Merci
Je devait faire une fiche atome en physique et cet article m’a beaucoup beaucoup aidé merci
Bonjour, et merci pour votre article. On parle beaucoup des sels d’aluminium, sait-on à quel état l’aluminium absorbé par le corps humain circule dans le corps (ions libres, aluminium inerte libre, sels).
On peut élargir la réponse. en solution aqueuse, sans autres compléxants on trouve 6 espèces de comp osés Al(OH)2+ , Al(OH)2 et 1+, Al(OH)3, Al(OH)4 et 1-, Al(OH)5 et 2-, Al(OH)6 et 3-. Si des complexants existent le nombre de composés sera plus élevé on y trouvera les composés de spéciation. La composition dans les organes humains dépendra de l’acidité et du pouvoir rédox des cellules. La j’aimerais lire les travaux qui ont été publiés
Bonjour Hervé,
Le corps peut absorber des sels d’aluminium présents dans les déodorants par exemple ou par ingestion sous forme ionique.
Bonjour, Pardonnez mon incompétence, mais j’ai entendu dire qu’à Tchernobyl, dans la centrale nucléaire, une importante masse d’uranium avait été “transmutée” en aluminium….
En imaginant que cette information soit exacte, cela vous semble-t-il concevable ?
De quelle façon pourrait-on l’envisager, si ce n’est par l’expérience, au moins par le calcul ?
Bonjour, la transmutation de l’Uranium (238) n’inclus pas de passage par de l’aluminium. La présence de dizaines de tonnes d’aluminium sur le site de Tchernobyl créée beaucoup de théories, mais sa véritable utilité n’a jamais été exprimée. En tous cas la transmutation de l’Uranium propose du plomb, qui aurait pu être utile en confinement nucléaire.
J’espère avoir répondu à votre question !