Chapitres
Le scandium est un élément chimique qui porte le numéro 21 dans la classification périodique des éléments.
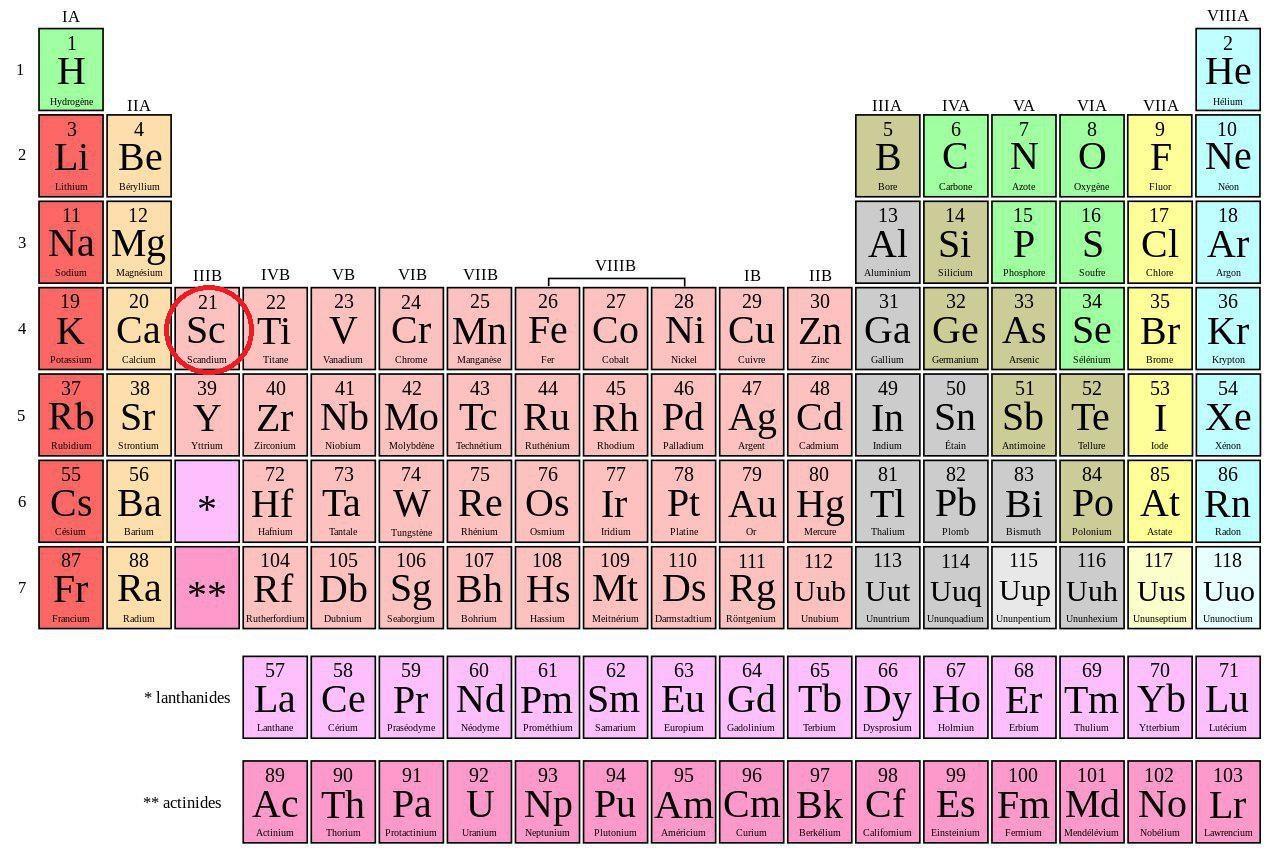
| Informations générales | |
|---|---|
| Symbole | Sc |
| Numéro atomique | 21 |
| Famille | Métal de transition |
| Groupe | 3 |
| Période | 4 |
| Bloc | d |
| Masse volumique | 2,989 g.cm-3 |
| Propriétés atomiques | |
| Masse atomique | 44,96 u |
| Rayon atomique | 160 pm |
| Configuration électronique | [Ar] 4s2 3d1 |
| Électrons par niveau d'énergie | 2 | 8 | 9 | 2 |
| Oxyde | Base faible |
| Propriétés physiques | |
| État ordinaire | Solide |
| Point de fusion | 1541 °C |
| Point d'ébullition | 2836 °C |
Définitions
- Numéro atomique : Le numéro atomique d'un atome représente le nombre de protons de ce dernier
- Famille : L'UICPA (Union internationale de chimie pure et appliquée) a regroupé en 10 familles les éléments chimiques qui présentent des propriétés physiques et chimiques semblables
- Groupe : Chaque groupe correspond aux éléments chimiques présents dans une même colonne du tableau périodique des éléments
- Période : Chaque période correspond aux éléments chimiques présents dans une même ligne du tableau périodique des éléments. Ils partagent également le même nombre de couches électroniques. On en compte 7 au maximum
- Bloc : Les éléments périodiques sont classés par bloc selon leurs propriétés et selon les couches électroniques jusqu’auxquelles elles sont remplies
- Dureté : La dureté d'un matériau représente la résistance qu'il oppose à la pénétration. On peut la mesurer selon plusieurs méthodes : la méthode par pénétration, la méthode par rayage ou encore la méthode par rebondissement
- Point de fusion : Le point de fusion correspond à un moment de pression et de température à partir duquel l'élément chimique fond, passant ainsi de l'état solide à l'état liquide
- Point d'ébullition : Le point d'ébullition correspond à un moment de pression et de température à partir duquel l'élément chimique bout, passant ainsi de l'état liquide à l'état gazeux
Rappel : La classification périodique des éléments, aussi appelée tableau de Mendeleïev, du nom de son créateur. C'est un chimiste russe qui en 1869 créa un tableau dont le but était de regrouper tous les éléments chimiques connus par points communs (groupes et familles par exemple). Il a souvent été ajusté et mis à jour depuis cette époque.
Sa dernière révision date de 2016 par l'UICPA (Union internationale de chimie pure et appliquée), une ONG suisse qui a pour but l'évolution de la physique-chimie. Le tableau périodique compte à ce jour 118 éléments.
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science.
L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologie des éléments chimiques et leurs dérivé via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.

Un peu d’histoire autour du scandium
Étymologie
Le nom du scandium vient du pays européen, la Scandinavie. Ce nom lui a été attribué en l'honneur de celui qui l'a découvert et qui été originaire de Scandinavie.
Découverte
Le scandium fut découvert en 1879 par un chercheur suédois, Lars Fredrik Nilson.
Lars Fredrik Nilson est un chimiste suédois ayant vécu entre 1840 et 1899. Diplômé de chimie, il est célèbre pour avoir réalisé la découverte du scandium, pour avoir été le premier à isoler le thorium ainsi que pour avoir déterminé la masse atomique du béryllium
La première production de scandium métallique est quant à elle plus récente, elle date de 1937. On en produit alors par électrolyse de potassium, de lithium et d'oxyde de scandium.
Présence à l’état naturel de l'élément 21
On trouve le scandium dans différents minerais tels que :
- La thorveitite,
- L'euxénite,
- La gadolinite.
Cependant, le scandium métallique n'est pas présent à l'état naturel.
C'est également l'élément le vingt-troisième plus présent dans le Soleil.
La production du scandium
Pour produire du scandium, on l'obtient principalement comme sous-produit de purification de l'uranium. Il est aussi possible d'en obtenir par réduction du fluorure de scandium.
Propriétés physiques et chimiques du scandium métallique
Le scandium est un métal assez mou et très léger. Il est trivalent. Cela signifie qu'il est capable de créer des liaisons atomiques avec trois autres atomes.
Au contact de l'air il change de couleur et prends des teintes jaunes ou rosées.
Les caractéristiques du scandium sont très proches de celles de l'élément 39 : l'yttrium.
Sous forme de poudre, le scandium peut devenir extrêmement inflammable.
Les isotopes du scandium
Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons
Le scandium possède 25 isotopes connus à ce jour, leurs nombre de masse variant de 36 à 60.
Le nombre de masse d’un atome est le nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome
On lui compte également 10 isomères nucléaires.
Des isomères nucléaires sont des atomes qui partagent le même noyau mais dans états énergétiques différents. C’est à dire qu’ils comportent un spin et une énergie d’excitation spéciaux. Dans leur état d’énergie le plus bas, on dit qu’ils atteignent l’état fondamental
Seul le scandium 45 est stable, ce qui fait de cet élément un élément monoisotopique et un élément mononucléidique.
On dit d’un élément qu’il est mononucléidique lorsque cet élément n’est présent sur Terre que sous la forme d’un seul nucléide, stable ou non.
On dit aussi qu'un élément est monoisotopique lorsqu'il ne possède qu'un seul isotope stable
Son radioisotope le plus stable est le scandium 46 avec une durée de demie-vie de 83 jours tandis que celui avec la plus petite durée de demie-vie est le scandium 44 avec une durée de demie-vie de 154 ns.
Les différentes utilisations du scandium

Le scandium a peu d'applications. En effet, sa production est faible, de l'ordre d'environ une tonne par an et son prix est très élevé. Pour cause, il faut compter plus de 8000 € pour un kilo de scandium.
Le scandium dans les lampes à halogénures de métal
Une lampe à halogénures de métal est une lampe à décharges électriques qui contient un gaz faisant partie de la famille des halogènes qui enrobe le filament. Ces lampes dispensent une lumière proche de la lumière du jour, aux alentours de 5600 K
On utilise le scandium dans certains types de lampes à halogénures de métal afin d'en faire une source lumineuse pour filmer la nuit par exemple.
Le scandium et l'aéronautique
Le scandium est utilisé en alliage, avec de l'aluminium notamment, dans le domaine de l'aéronautique. Du fait de ses caractéristiques, il renforce beaucoup les caractéristiques de l'aluminium, avec son pouvoir antirecristallisant par exemple.
Le scandium marqueur de radioactivité
On utilise l'isotope scandium 46 dans l'industrie du pétrole comme marqueur radioactif. Sa demie-vie étant courte (84 jours) il permet de détecter les fuites de canalisations ainsi que pour le fonctionnement du cassage.
Les utilités des oxydes de scandium
L'oxyde de scandium, de formule Sc2O3 sert de revêtement sur les surfaces optiques grâce à sa dureté, à sa transparence aux UV ainsi qu'à sa grande résistance. De plus, il a des propriétés anticorrosives.
Les dangers du scandium
Le scandium est quelque peu toxique s'il est ingéré. Si jamais il est inhalé en de trop grandes quantités, il peut causer des embolies pulmonaires.
Il est important de manipuler le scandium avec précaution car celui-ci peut être dangereux. En effet, les vapeurs et les gaz de scandium peuvent provoquer des embolies pulmonaires. Ce risque est d’autant plus accru si l’exposition devient prolongée.
En général, le scandium, comme les autres terres rares dont les propriétés sont comparables, s’accumulent dans le foie lorsqu’ils sont absorbés.
Écotoxicité de l'élément 21
On dit d’un objet qu’il est écotoxique lorsqu’il est toxique pour l’environnement, c’est-à-dire polluant
Le scandium, chez les animaux aquatiques, peut provoquer des dommages au niveau des membranes cellulaires, pénalisant les animaux sur la reproduction mais également sur le système nerveux.
Ces animaux peuvent être mis en contact avec le scandium, qui est considéré comme écotoxique à cause des activités humaines.
En effet, le scandium et d’autres terres rares sont rejetés dans l’environnement via les industries pétrolières mais aussi par les particuliers abandonnant dans la nature certains équipements ménagers comme les télévisions.
Le scandium va alors s’accumuler dans le sol et en augmenter les concentrations jusqu’à ruissellement dans le cours d’eau le plus proche























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
pourquoi le degre d’oxydation de Sc est 3+ ??