Chapitres
Le radium est un élément chimique qui porte le numéro 88 dans la classification périodique des éléments. 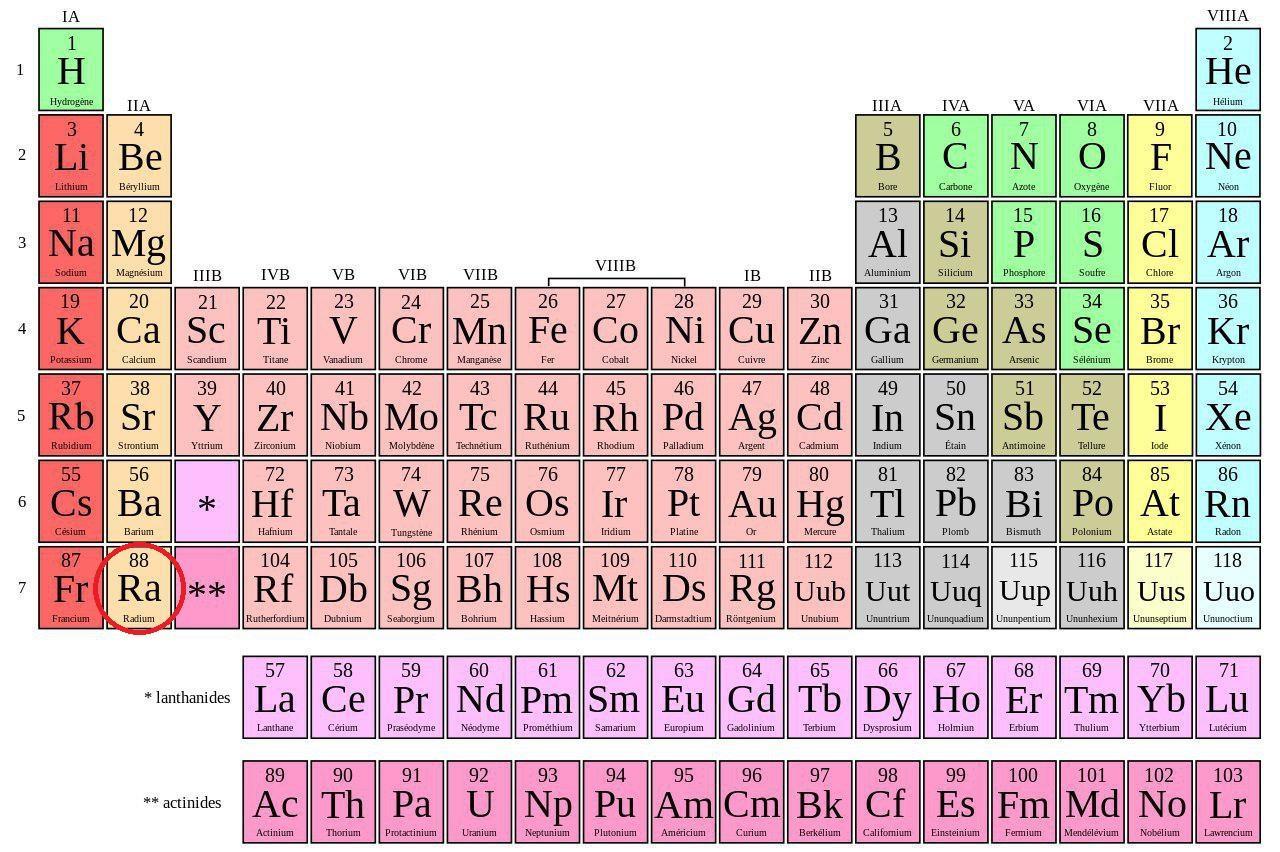
| Informations générales | |
|---|---|
| Symbole | Ra |
| Numéro atomique | 88 |
| Famille | Métal alcalino-terreux |
| Groupe | 2 |
| Période | 7 |
| Bloc | s |
| Masse volumique | 5 g.cm-3 |
| Couleur | Blanc gris |
| Propriétés atomiques | |
| Masse atomique | 226 u |
| Rayon atomique | 215 pm |
| Configuration électronique | [Rn] 7s2 |
| Électrons par niveau d'énergie | 2 | 8 | 18 | 32 | 18 | 8 | 2 |
| Oxyde | Base forte |
| Propriétés physiques | |
| État ordinaire | Solide |
| Point de fusion | 696 °C |
| Point d'ébullition | 1736,85 °C |
Définitions
- Numéro atomique : Le numéro atomique d'un atome représente le nombre de protons de ce dernier
- Famille : L'UICPA (Union internationale de chimie pure et appliquée) a regroupé en 10 familles les éléments chimiques qui présentent des propriétés physiques et chimiques semblables
- Groupe : Chaque groupe correspond aux éléments chimiques présents dans une même colonne du tableau périodique des éléments
- Période : Chaque période correspond aux éléments chimiques présents dans une même ligne du tableau périodique des éléments. Ils partagent également le même nombre de couches électroniques. On en compte 7 au maximum
- Bloc : Les éléments périodiques sont classés par bloc selon leurs propriétés et selon les couches électroniques jusqu’auxquelles elles sont remplies
- Dureté : La dureté d'un matériau représente la résistance qu'il oppose à la pénétration. On peut la mesurer selon plusieurs méthodes : la méthode par pénétration, la méthode par rayage ou encore la méthode par rebondissement
- Point de fusion : Le point de fusion correspond à un moment de pression et de température à partir duquel l'élément chimique fond, passant ainsi de l'état solide à l'état liquide
- Point d'ébullition : Le point d'ébullition correspond à un moment de pression et de température à partir duquel l'élément chimique bout, passant ainsi de l'état liquide à l'état gazeux
Rappel : La classification périodique des éléments, aussi appelée tableau de Mendeleïev, du nom de son créateur. C'est un chimiste russe qui en 1869 créa un tableau dont le but était de regrouper tous les éléments chimiques connus par points communs (groupes et familles par exemple). Il a souvent été ajusté et mis à jour depuis cette époque. Sa dernière révision date de 2016 par l'UICPA (Union internationale de chimie pure et appliquée), une ONG suisse qui a pour but l'évolution de la physique-chimie. Le tableau périodique compte à ce jour 118 éléments. L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science. L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologie des éléments chimiques et leurs dérivé via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.

Un peu d’histoire autour de l'élément 88
Étymologie
Le nom radium provient du latin "radius" qui signifie "rayonnement". Il a été nommé ainsi à cause de la forte émission de rayonnements radioactifs du radium.
Découverte du radium

Marie Skłodowska-Curie
Marie Skłodowska-Curie est une physicienne et chimiste d’origine polonaise. Elle est très connue pour sa découverte de la radioactivité naturelle et des éléments 84 et 88 : le polonium et le radium. Elle reçut de multiples prix et distinctions pour ses recherches. Elle reçut en 1903 le prix Nobel de physique et en 1911 le prix Nobel de chimie. C’était la première femme à recevoir ce genre de distinction et encore à ce jour elle est la seule à en avoir reçu deux.
Présence à l’état naturel
On trouve du radium dans des minerais tels que la pechblende où il est présent sous forme de traces combinées à de l'uranium par exemple.
Pechblende
La pechblende, également appelée uraninite, est une espèce minérale radioactive. Celle-ci est composée majoritairement d'uranium, elle est d'ailleurs considéré comme étant le principal minerai d'uranium. C'est dans ce minerai que Pierre et Marie Curie ont découvert la radioactivité en extrayant du radium de la pechblende. Le célèbre minerai exploité par Pierre et Marie Curie provenait du gisement de Jachymov en République Tchèque. Ce gisement, très célèbre, même le plus connu, est à ce jour épuisé. On trouve environ 1 g de radium pour 3 tonnes de pechblende. Le radium entre également dans la composition des gaz de schiste. Plus ces derniers sont noirs, plus ils en contiennent. Il y a également des traces de radium dans le charbon contenant de l'uranium.
Propriétés physiques et chimiques du radium sous toutes ses formes
Le radium est un métal qui fait partie de la famille des alcalino-terreux. De tous les métaux qui en font partie, il est le plus dense. Comme ces derniers, le radium partage leurs caractéristiques. Très proche du baryum, il est cependant beaucoup moins étudié que ce dernier à cause de sa très grande radioactivité qui demande de nombreuses précautions. Quand il est pur, le radium est blanc mais il s'oxyde rapidement à l'ai et devient noir, il y alors formation de nitrite. Il est luminescent et émet une lumière bleue. C'est un élément très réactif. En contact avec l'eau il forme de l'hydroxyde de radium.
Isotopes radioactifs du radium
Des isotopes sont des atomes qui possèdent le même nombre de protons mais un nombre différent de neutrons
A ce jour, on connait 32 isotopes du radium, leur nombre de masse allant de 202 à 234. Tous sont radioactifs.
Le nombre de masse d’un atome est le nombre de nucléons qu’il contient. Il s’agit donc de la somme du nombre de protons et du nombre de protons qui constituent le noyau de l’atome
L'isotope du radium avec la plus longue durée de demie-vie est le radium 226 qui a une durée de demie-vie de 1600 années tandis que celui avec la plus petite durée de demie-vie est le radium 216 avec une durée de demie-vie de 182 ns.
La production du radium
Comme il est produit à partir d'uranium, le radium dépend beaucoup des extractions d'uranium et des mines où cette extraction a lieu. On extrait l'uranium de divers pays :
- L’Autriche,
- Les Etats-Unis,
- Le Canada.
Cependant, la production de radium dans le monde n'a jamais été vraiment importante à travers le monde. On compte qu'il est produit chaque année environ 100 grammes de radium. A ce jour, le radium est principalement produit en Belgique, au Royaume-Uni ainsi qu'au Canada.
Utilisations de cet élément radioactif
On utilise le radium pour ses capacités radioactives. 
Le radium luminescent
Grâce à ses propriétés luminescentes, on utilisait le radium comme source phosphorescente pour les cadrans d'horloges par exemple. Cependant, cette utilisation fut stoppée dans les années 1950 à cause des risques qu'elle engendrait, autant pour les ouvriers qui produisaient les horloges à base de radium que pour les clients qui s'en servaient par la suite.
Le radium en médecine
On utilisait le radium dans la curiethérapie, une technique qui consistait à irradier les tumeurs avec l'injections de fortes doses de radium très localisées dans le corps. Cependant il fallut vite oublier cette application car elle créait de trop fortes expositions pour les opérateurs qui devaient injecter la souche radioactive. C'est pourquoi la curiethérapie a été abandonnée au profit de la radiothérapie.
Le radium et les ions
On utilisait également le radium comme source d'ionisation, autour des paratonnerres, afin d'augmenter l'ionisation naturelle autour de ces derniers. Cependant, comme leur efficacité n'a jamais été démontrée, ces paratonnerres radioactifs, appelés parads ont été abandonnés. On se sert aujourd'hui du radium dans les détecteurs de fumées, la conductivité électrique du radium se modifiant et permettant ainsi de déclencher l'alarme dans les lieux publics ou dans les entreprises.
Dangers du radium
Les effets du radium sur la santé sont considérables. Beaucoup de scientifiques en ont fait les frais, que ce soit Henri Becquerel ou Pierre Curie, en passant par les époux Curie ou tous ceux qui ont approché cet élément de près sont décédés des suites de la radioactivité. En effet, il était encore méconnu que la radioactivité pouvait être si nocive pour la santé et pour les environnements.
Les risques sanitaires pour l'Homme
Du fait de sa radioactivité gamma très élevée, le radium peut vite devenir très toxique et causer des graves lésions irréparables chez l'Homme.
La radioactivité gamma est un rayonnement provoqué par une désintégration gamma. Le plu souvent, ces désintégrations accompagnent des désintégrations alpha ou bêta. En effet, quand il émet un rayon alpha ou bêta, le noyau devient excité. lors de l’émission d’un rayonnement électromagnétique gamma, le noyau peut donc redescendre à un état plus stable
Il peut s'ingérer involontairement dans la nourriture ou l'on peut y être exposé dans l'air, sous forme de gaz. Ces rejets proviennent la plupart du temps de déchets radioactifs de l'industrie.
La contamination des sols

On dit d’un objet qu’il est écotoxique lorsqu’il est toxique pour l’environnement, c’est-à-dire polluant
Le seul isotope de radium qui constitue un risque pour la nature est le radium 22 car c'est le seul à avoir une durée de demie-vie assez longue pour être assimilé par la biosphère.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !