Chapitres

Caractérisation de l’actinium
Aspect et description de l'actinium
L’actinium est un élément chimique classé dans le tableau périodique (aussi appelé tableau de Mendeleïev). C’est le premier élément de la famille des actinides. C’est d’ailleurs cet élément qui a donné son nom à la famille entière des actinides car ce fut le premier à être découvert. Actinium est un nom venant du grec aktinos (signifiant « rayon »). Ce nom provient de la pâle lumière bleue que l’actinium émet dans le noir du fait de sa radioactivité. On parle aussi d’incandescence.
Dans la nature, l’actinium est un métal mou de couleur blanche voire argentée, très radioactif (environ 150 fois plus que le radium).
En contact avec l’oxygène et l’humidité de l’air, l’actinium se transforme en oxyde d’actinium, formant une pellicule blanche en surface. En revanche, en solution (dans de l’eau), l’actinium est incolore.
Constitution électronique
Le numéro atomique de l’actinium étant 89, cela signifie que cet élément chimique dispose de 89 protons, et donc d’autant d’électrons afin d’être électriquement neutre. Il présente également 138 neutrons. Ces 89 électrons sont répartis sur les différentes couches électroniques, de la plus proche du noyau à la plus éloignée, comme suit : (K)2 (L)8 (M)18 (N)32 (O)19 (P)8 (Q)2. 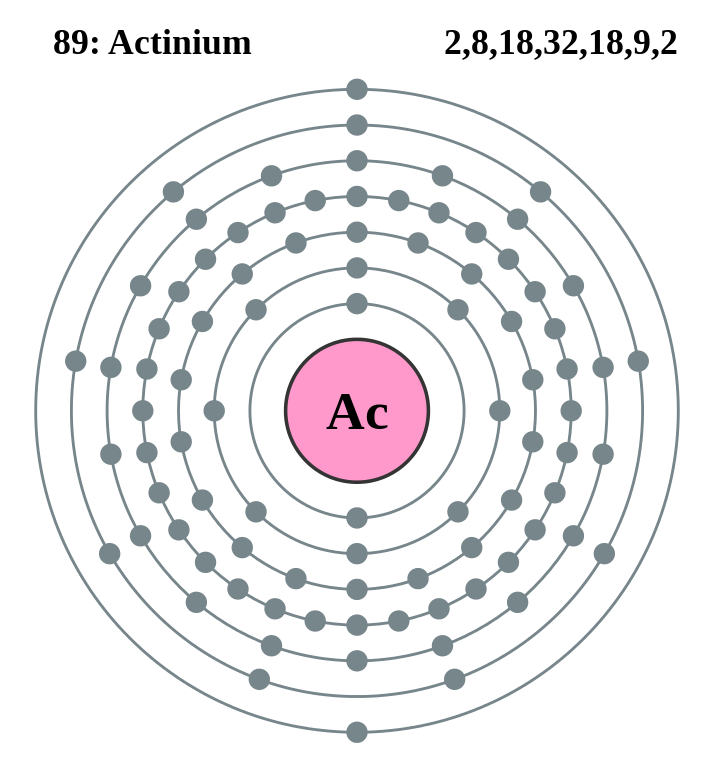
Actinium et tableau périodique
Le numéro atomique de l’actinium étant 89, il est positionné dans le tableau périodique entre le radium (88) et le thorium (90). L’actinium est le premier élément de la famille des actinides (famille aussi appelée série chimique). 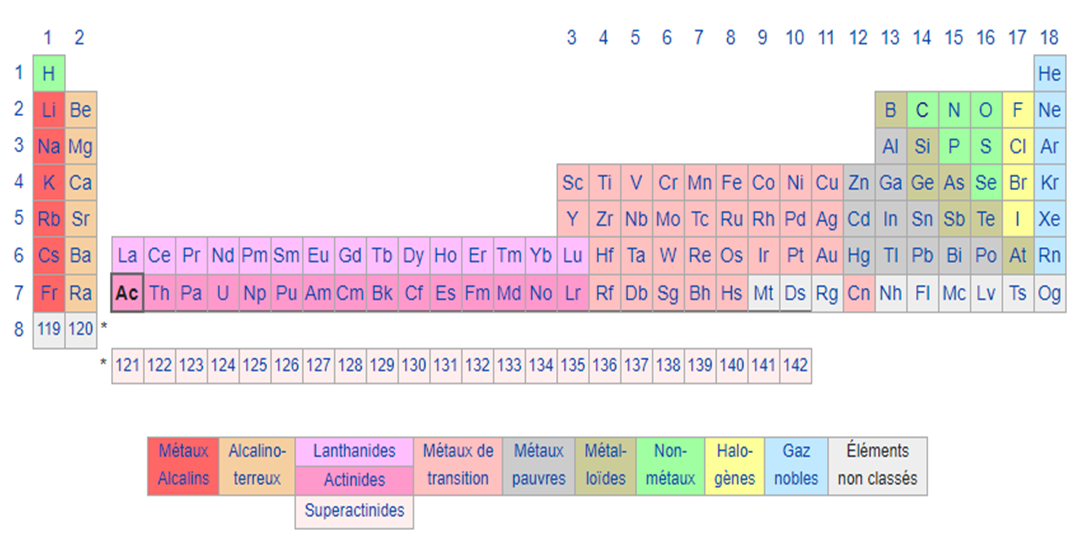
Principales caractéristiques
Dans le tableau ci-dessous sont présentées les principales caractéristiques de l’actinium.
| Caractéristiques | Données |
|---|---|
| Nom complet de l'élément chimique | Actinium |
| Symbole | Ac |
| Numéro atomique | 89 |
| Famille | Actinides |
| Couleur | Blanc argenté |
| Etat classique | Solide |
| Rayon atomique | 195 pm |
| Rayon de covalence | 215 pm |
| Masse atomique | 227 g / mol |
| Electronégativité de Pauling | 1,1 |
| Volume molaire | 22,55x10-6 m3/mol |
| Température de fusion | 10,07 g / cm3 à 20°C |
| Energie de fusion | 1050 °C |
| Température d'ébullition | 62 kJ /mol |
| Configuration électronique orbitale | 3198 °C |
| Energie de première ionisation | 6d1 7s2 |
| Energie de seconde ionisation | 664,6 kJ/mol = 5,17 eV |
| Potentiel standard | 1165,5Kj/mol = 11,75 eV |
| Conductivité thermique | V |
Isotopes
Il existe 31 isotopes connus pour l’actinium, c’est-à-dire 31 « versions » d’actinium différentes avec un nombre de masses variables. Les masses correspondent aux neutrons additionnés aux protons. Or le nombre de protons restant fixe (89 pour l’actinium), c’est donc le nombre de neutrons qui varie d’un isotope à l’autre. Ainsi, il existe les isotopes de 206Ac à 236Ac. Toutefois, dans la nature, seuls sont présents ceux qui sont stables, c’est-à-dire les isotopes 227Ac et 228Ac. Ces deux isotopes sont les produits intermédiaires de la désintégration de l’uranium 235U et 238U respectivement.
Dans la nature, l’isotope 227Ac est le plus abondant, tandis que le 228Ac est extrêmement rare, les autres isotopes sont encore plus rares.
La stabilité de l’isotope 227Ac amène à une demi-vie de 21,772 ans ; tandis que l’isotope 225Ac a une demi-vie de 10 jours, et l’isotope 226Ac de 29,37 heures. Parmi les autres isotopes, certains ont une demi-vie inférieure à 10h tandis que les demi-vies d’autres isotopes n’atteignent même pas une minute.
La demi-vie est donc très variable d’un isotope à l’autre de l’actinium.
Remarque : Le temps de demi-vie est une estimation du temps nécessaire pour que la moitié d’une quantité d’un élément chimique soit désintégrée. Exemple : Si on dispose de 100 atomes de 227Ac à T0, on estime qu’il restera 50 atomes dans 21,772 ans. En outre, l’actinium 227Ac est le premier à avoir été découvert.
Ressources en actinium et fabrication
Ressources et abondance en actinium
L’actinium est principalement retrouvé sous forme de trace dans l’uranium en très faibles quantités : à peine 0,1g dans une tonne d’uranium. Cela s’explique car l’uranium se désintègre en actinium lors de la réaction nucléaire. Pour être plus précis, le rapport de poids entre actinium et uranium a été estimé à 2x10-10. 
Production d’actinium
Seul l’isotope 227Ac de l’actinium peut être obtenu et extrait en quantité pondérable.
L’actinium est généralement obtenu par deux méthodes principales.
- La première consiste à l’extraire et à l’isoler de l’uranium qui s’est désintégré lors de la réaction nucléaire. Toutefois, cette technique ne permet pas d’obtenir un isolat pur, car l’actinium reste souvent associé aux terres rares dont les propriétés chimiques sont très proches.
- La seconde méthode consiste à bombarder du radium avec des neutrons dans un réacteur nucléaire.
Remarque : La forme métallique de l’actinium peut aussi être obtenue en réduisant du fluorure d’actinium avec de la vapeur de lithium. Toutefois, cette réaction nécessite des températures assez importantes comprises entre 1100°C et 1300°C.
Histoire de l’actinium
Découverte
En 1881, Thomas Lamb Phipson constate un noircissement du blanc de sulfure de zinc sous l’influence de la lumière du soleil. Il pense alors que ce noircissement provient d’une mauvaise qualité du zinc commercial qu’il achetait et qui aurait contenu des impuretés. Sans le savoir, il a ainsi été le premier à manipuler de l’actinium.
C’est finalement et officiellement André-Louis Debierne qui aura découvert et nommé l’actinium en 1899 en manipulant des mélanges d’oxydes de terres rares et plus particulièrement de la penchblende.
C’est ce même homme qui travaillait avec Pierre et Marie Curie. Ces derniers avaient alors découvert peu de temps auparavant l’uranium, le polonium et le radium.
Histoire des sciences : le classement périodique de l’actinium
La découverte de l’actinium nécessita de classer ce nouvel élément chimique dans le tableau périodique. Toutefois, les découvertes de nouveaux éléments chimiques se succédant sur la fin du 19e siècle, il était ardu de tous les classer dans un tableau qui apparaissait alors déjà complet dans son ancienne structure. Ce sont la théorie des transformations radioactives de Rutherford et Soddy ainsi que la loi des déplacements radioactifs de Soddy et Fajans qui ont permis de caractériser l’actinium en vue de le classer par la suite. En 1928, Charles Janet proposa une nouvelle version du tableau périodique en revoyant la structure générale de celui-ci afin de pouvoir classer tous les nouveaux éléments découverts. Il fallut attendre 1945 pour que le projet soit de nouveau abordé à la demande de Glenn T. Seaborg. Les familles des actinides et des lanthanides présentant des caractéristiques chimiques communes, il était logique que ces deux familles soient proches sur le tableau périodique. Le groupe des actinides est toutefois un peu plus varié que celui des lanthanides.
Applications de l’actinium
Propriétés
Les propriétés de l’actinium étant voisines de celles du lanthane et de la famille des lanthanides, cela rend son extraction et sa purification difficile. Pour ce faire, il est possible d’utiliser la chromatographie ionique qui apparait jusqu’à maintenant comme étant la meilleure méthode de séparation et de purification de l’actinium. Sur sa couche électronique la plus externe, l’actinium dispose de 3 électrons de valence, c’est-à-dire de 3 électrons pouvant former des liaisons avec d’autres atomes. Ces 3 électrons peuvent également être cédés afin de se transformer en radon qui est le gaz rare le plus proche et particulièrement stable. Il est beaucoup plus rare que l’atome d’actinium cède un unique électron afin de donner du dihydrure d’actinium.
En outre, la principale propriété de l’actinium est sa très forte radioactivité, environ 150 fois plus importantes que celle du radium.
Utilisations et applications
De manière générale, l’actinium est assez peu utilisé, notamment en raison de sa rareté. Les applications de l’actinium proviennent principalement de sa forte radioactivité, faisant de l’actinium une source de neutrons importante. Il est également utilisé en dans les générateurs thermoélectriques à radioisotope. En médecine, l’actinium 225Ac peut être utilisé en radiothérapie pour le traitement de multiples cancers. Dans cette optique, il peut également être utilisé en tant que précurseur du bismuth 213Bi dans un générateur.
Ainsi, la principale utilisation de l’actinium se retrouve en cancérologie.
En géologie, l’actinium 227Ac ayant une demi-vie de 22 ans, il permet l’étude des mouvements verticaux dans les fonds océaniques.
Effets de l'actinium
L’actinium, en raison de sa radioactivité, est particulièrement toxique : autant que le plutonium. Des expériences menées chez le rat ont montré que l’actinium pouvait être stocké dans le foie ou dans les os. Le rayonnement de l’actinium se concentre au fil de la chaine alimentaire. Ainsi, des animaux et des humaines peuvent être soumis aux effets néfastes de l’actinium alors qu’ils ne sont pas en contact avec l’actinium dans la nature. Le principal risque consiste en des mutations de l’ADN, dont les effets peuvent être aussi divers que variés, et potentiellement transmissibles à la descendance. Certaines mutations peuvent amener à des cancers. Ces effets sont valables pour tous les êtres vivants, c’est-à-dire aussi bien pour les animaux (dont les humains) que pour les plantes, avec les mêmes conséquences.
Le principal effet toxique de l’actinium est donc son effet cancérigène, ce qui n’est pas incohérent avec son utilisation en médecine.






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !