Chapitres

Description d'un solide moléculaire ?
Comme son nom peut le laisser deviner un solide moléculaire est un solide constitué uniquement de molécules.
Par définition une molécule est un ensemble neutre, c’est à dire qui ne porte par de charges électriques.
Les molécules sont constituées d’éléments simples, les atomes. Ces atomes sont liés les uns aux autres par l’intermédiaire de liaisons covalentes dans l’espace de manière ordonnée. Ces liaisons covalentes peuvent parfois être polarisées. La cohésion d’un solide moléculaire est assurée par deux types d’interactions qui représentent des interactions faibles :
- Les interactions de Van der Waals
- La liaison hydrogène
Rappel : un solide ionique est constitué d’un empilement de cations et d’anions.
Qu'est-ce que l'électronégativité ?
Définition de l'électronégativité
L’électronégativité peut se caractériser par la tendance qu’à un élément d’attirer les électrons. Plus un élément est électronégatif et plus il aura tendance à attirer les électrons.
Par définition une liaison covalente correspond à la mise en commun de deux électrons par deux atomes, cependant il arrive que ce partage d’électrons ne se fasse pas à "parts égales" et que l’un des atomes exerce une attraction plus forte que l’autre : les électrons sont alors "décalés" vers celui-ci et on dit que cet atome est plus électronégatif.
L’électronégativité caractérise donc la tendance d’un atome à attirer vers lui les électrons qui font parte d’une liaison covalente.
L'électronégativité des différents élément de la classification
L’électronégativité est une caractéristique qui varie dans la classification périodique.
Sur une période l’électronégativité augmente de gauche à droite ainsi, par exemple, le fluor est plus électronégatif que l’oxygène qui est lui-même plus électronégatif que l’azote etc.…
Dans une colonne, l’électronégativité augmente du bas vers le haut ainsi, par exemple, l’oxygène est plus électronégatif que le soufre qui est lui même plus électronégatif que le sélénium.
Quelques numéro atomiques à retenir :
| Elément | Numéro atomique |
|---|---|
| H | 1 |
| C | 6 |
| N | 7 |
| O | 8 |
| P | 15 |
| S | 16 |
| Cl | 17 |
Les liaisons polarisées
Dans un solide moléculaire les atomes sont liés par des liaisons covalentes : les deux atomes mettent en commun leurs électrons célibataires pour créer un doublet liant. Quand les deux atomes sont identiques, la paire d’électron qui relie les deux atomes est répartie équitablement entre les deux atomes. On dit alors que la molécule est apolaire. Quand deux atomes qui mettent leurs électrons en jeu sont différents et qu’il existe une différence d’électronégativité significative entre ces deux atomes, la liaison est dire polarisée et on appelle ce type de molécule, molécule polaire. Définition : une liaison covalente est dite polarisée si les deux atomes qui sont liés ont des électronégativités très différentes. En effet, dans ce cas, un des deux atomes aura tendance à attirer les électrons, ce qui a pour effet de polariser la liaison. Plus la différence d’électronégativité est grande et plus la polarisation de la liaison sera importante. Il se forme ainsi une sorte de dipôle électrique. Le décalage des électrons conduit à noter une charge partielle négative δ– sur l’atome le plus électronégatif et une charge partielle positive δ+ sur le moins électronégatif. Ces charges partielles ont une valeur comprise entre 0 et 1. Plus la valeur est importante et plus la charge est forte. Cas particulier : quand une valeur atteint 1, cela veut dire que l’atome électronégatif est tellement fort qu’il prend le doublet d’électrons pour lui tout seul ! Une sorte de hold-up électronique. On parle alors de liaison ionique.
Quelques exemples de liaisons polarisées ou non
La molécule de dihydrogène
Le numéro atomique du dihydrogène est 1, cela signifie que, selon sa répartition électronique, il possède un électron célibataire. La molécule de dihydrogène est composée de deux atomes identiques d’hydrogène. Ces deux atomes ont exactement la même électronégativité ainsi la liaison n’est pas polarisée et la molécule est apolaire.
La molécule d’eau
La molécule d’eau est une molécule composée d’une molécule d’oxygène et de deux molécules d’hydrogène. La molécule d’hydrogène possède un numéro atomique de 1, l’oxygène possède un numéro atomique de 8. Dans la classification périodique, l’oxygène se trouve beaucoup plus à droite que l’hydrogène. L’oxygène est ainsi beaucoup plus électronégatif que l’hydrogène. La molécule d’eau est donc polarisée.
Autres exemples
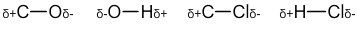
- La liaison C-O comprend un atome de carbone (numéro atomique de 6) et un atome d’hydrogène (numéro atomique de 8). L’atome d’oxygène est placé à droite de l’atome de carbone dans la classification périodique, il est donc plus électronégatif. On note donc que la liaison est polarisée avec une charge partielle positive sur l’atome de carbone et une charge partielle négative sur l’atome d’hydrogène.
- La liaison O-H comprend un atome d’oxygène (numéro atomique de 8) et un atome d’hydrogène (numéro atomique de 1). L’atome d’oxygène est placé à droite dans la classification périodique par rapport à l’atome d’hydrogène. La liaison est polarisée avec l’hydrogène portant une charge partielle positive et l’oxygène portant une charge partielle négative.
- La liaison C-Cl comprend un atome de carbone (numéro atomique de 6) et un atome de chlore (numéro atomique de 17). L’atome de chlore est situé à droite de l’atome de carbone dans la classification périodique. La liaison est polarisée et on note une charge partielle positive sur l’atome de carbone et une charge partielle négative sur l’atome de chlore.
- La liaison H-Cl comprend un atome d’hydrogène (numéro atomique de 1) et un atome de chlore (numéro atomique de 17). L’atome de chlore est situé à droite de l’atome d’hydrogène dans la classification périodique. La liaison est polarisée et on note une charge partielle positive sur l’atome d’hydrogène et une charge partielle négative sur l’atome de chlore.
Remarque : Pour certains atomes la différence d’électronégativité est si faible qu’on peut considérer que la liaison n’est pas polarisée. C’est en particulier le cas pour la liaison entre un atome de carbone et un atome d’hydrogène que l’on retrouve dans les molécules organiques.
L'interaction de Van der Waals
Les interactions de Van der Waals sont des interactions faibles inter-moléculaires. Le nom de ces interactions à été donné en l’honneur du physicien Johannes Diderik Van der Waals, prix Nobel de physique. Dans les solides moléculaires il existe une interaction qui s’exerce entre les molécules appelée interaction de Van der Waals : elle est d’autant plus importante que les liaisons sont polarisées. Les interactions de Van der Waals sont donc des interactions entre dipôles électriques. Cependant l’interaction de Van der Waals peut s’exercer aussi sur des liaisons et atomes initialement non polarisés mais dont l’environnement (les atomes voisins) provoque une polarisation temporaire. Les interactions de Van der Waals ne concernent que des atomes se trouvant à une très courte distance. Quand les atomes sont suffisamment proches, les électrons de l’un sont attirés par le noyau de l’autre atome. Cependant si les atomes sont trop rapprochés, l’effet inverse se produit, il y a une sorte de répulsion.
L’interaction de Van der Waals est donc une interaction électrique entre les charges partielles de liaisons ou d’atomes polarisés de manière permanente ou temporaire: elle assure la cohérence des solides moléculaires.
Note : même si les liaisons hydrogènes sont beaucoup plus intenses que les interactions de Van der Waals, ces deux types de liaison sont nettement moins fortes que les liaisons covalentes. Le saviez vous ?

Le gecko utilise les forces de Van der Waals pour grimper aux murs. Le gecko est un petit lézard aux capacités étonnantes. Il est capable de marcher au plafond ou d’escalader les murs les plus lisses. Non seulement il ne tombe pas mais il peut se mouvoir à des vitesses vertigineuses ! Alors comment fait il ? Les pattes des geckos sont formées d’unités microscopiques de l’ordre d’une centaine de nanomètres appelées spatules. Ces spatules sont tellement fines qu’elles peuvent se rapprocher très finement de la structure sur laquelle le gecko s’agrippe. Ce rapprochement permet aux forces de Van der Waals de pouvoir s’exercer.
La liaison hydrogène
Cette interaction peut se produire lorsque un atome d’hydrogène qui est lié à un atome très électronégatif (comme l’oxygène) est attiré par un autre atome éléctronégatif. En effet, l'atome d'hydrogène interagit alors avec les doublets non liants d’atomes électronégatifs comme l’oxygène, le chlore ou l’azote.
Cette interaction est nettement plus intense que celle de Van der Waals.

Ce type de liaison est généralement représentée à l’aide de pointillés. On trouve de nombreuses liaisons hydrogènes dans la molécule d’eau : l'atome d'oxygène qui possède deux doublets électroniques et deux électrons célibataire est plus électronégatif que l'hydrogène, qui lui ne possède qu'un seul électron célibataire. Les hydrogènes liés à l'oxygène sont attirés par les doublets des oxygènes des molécules d'eau avoisinantes. Ce type de liaison permet une certaine stabilité. On retrouve aussi ce type de liaison dans la molécule d'ADN.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
est ce que br2 est un solide moléculaire?
Merci pour la partage d’informations, c’est clair et concis.
Je suis en BTS diététique et n’ai pas dotée d’un bagage scientifique de base, il est donc primordial que je me mette à niveau en chimie pour bien appréhender la biochimie !
Ces supports m’aident vraiment donc merci.
Célia
Bonjour, je suis élèves de première S, je travaille en TPE sur le biomimétisme et plus particulièrement le gecko. Pour réaliser ce TPE je dois faire une expérience pouvant démontrer la loi de Van der Waals. Avez vous des idées? merci d’avance.
Bonjour Matthias,
Il existe des expériences intéressantes sur le biomimétisme à réaliser sur les geckos. Voici un lien vers une vidéo d’un scientifique qui vous expliquera tout ça en détails ! https://www.youtube.com/watch?v=8C9nkWU_Twc
Bonne journée
Est-il possible d’utiliser une molecules solides en quelques chose du quotidien ?
Bonjour Capucine,
Une molécule ne possède pas d’état, c’est l’association de molécules qui peut être solide, liquide ou gazeuse.
Bonne journée
Comment casser des liaisons hydrogènes?
On peut casser les liaisons hydrogène en augmentant leur énergie d’agitation (chauffer) car la chaleur augmente l’agitation des atomes.