Chapitres

Résumé d'une réaction chimique excès/limitant
📖 Les notions de réactif en excès et réactif limitant sont à mettre en contexte avec celle de réaction chimique. En effet :
Un réactif est dit limitant s'il est entièrement consommé lors d'une réaction chimique. Il s'agit donc du réactif dont la disparition totale empêche la poursuite de la réaction chimique.
Un réactif est en excès s'il n'est pas entièrement consommé lorsque la réaction s'arrête et que l'autre réactif a totalement disparu.
👉 Ainsi, lors d'une réaction chimique :
- Le réactif limitant est celui dont le rapport de la quantité de matière par son coefficient stœchiométrique est le plus faible
- Le réactif en excès est celui dont le rapport de la quantité de matière par son coefficient stœchiométrique est le plus élevé
Repérer le réactif limitant et le réactif en excès 🤓

🤔 Pour distinguer le réactif limitant et le réactif en excès il suffit de faire dans un premier temps l'hypothèse que :
- A est le réactif limitant (il disparaît entièrement) donc à l'état final (lorsque x=xmax) : nA = 0
- Ce qui signifie qui signifie aussi que

- Donc dans cette hypothèse
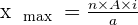
De la même manière si l'on fait l'hypothèse que B est le réactif limitant alors on obtient :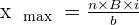
Le vrai réactif limitant est celui qui conduit à l'avancement le plus faible ce qui signifie que :
- Si
 alors le réactif limitant est A et le réactif en excès est B
alors le réactif limitant est A et le réactif en excès est B - Si
 alors e réactif limitant est B et le réactif en excès est A
alors e réactif limitant est B et le réactif en excès est A
Définition du réactif en excès
Le réactif en excès, également appelé "réactif excessif", est un concept essentiel en chimie lorsqu'on étudie les réactions chimiques.
👉 Il désigne le réactif présent en quantité supérieure à celle requise pour réagir complètement avec un autre réactif, le réactif limitant, afin de former les produits de la réaction
Après la réaction, une partie du réactif en excès reste intacte, car il n'a pas été entièrement consommé. Le réactif en excès n'influence pas le rendement de la réaction, car il ne participe pas à la formation de produits supplémentaires.
Pour identifier le réactif en excès dans une réaction chimique, il est essentiel de connaître la quantité initiale de chaque réactif utilisé et les coefficients stœchiométriques de l'équation chimique équilibrée. Les étapes pour identifier le réactif en excès sont les suivantes :
- Écrire l'équation chimique équilibrée de la réaction.
- Calculer la quantité de produit formé à partir de chaque réactif, en utilisant les coefficients stœchiométriques.
- Comparer les quantités de produit formé pour chaque réactif. Le réactif qui produit la plus petite quantité de produit est le réactif limitant, tandis que le réactif qui produit la plus grande quantité de produit est le réactif en excès.
✅ Prenons l'exemple de la réaction entre l'hydrogène (H2) et l'oxygène (O2) pour former de l'eau (H2O). Si nous avons 4 moles d'hydrogène et 2 moles d'oxygène, l'équation chimique équilibrée est :
2 H2 + O2 → 2 H2O
Pour déterminer le réactif en excès, nous devons calculer la quantité de produit formé par chaque réactif :
- Hydrogène : 4 moles d'H2 × (2 moles H2O / 2 moles H2) = 4 moles d'H2O formées
- Oxygène : 2 moles d'O2 × (2 moles H2O / 1 mole O2) = 4 moles d'H2O formées
Dans cet exemple, les deux réactifs produisent la même quantité de produit, soit 4 moles d'eau. Il n'y a donc pas de réactif en excès dans cette réaction.
Définition du réactif limitant
Le réactif limitant est un concept fondamental en chimie qui désigne le réactif présent en quantité insuffisante pour réagir complètement avec un autre réactif lors d'une réaction chimique.
👉 Il dicte le taux de formation des produits et limite la quantité de produit formé, car il est totalement consommé avant que les autres réactifs ne soient épuisés.
Identifier le réactif limitant est crucial pour déterminer le rendement de la réaction et prévoir la quantité maximale de produit pouvant être obtenue. Pour identifier le réactif limitant dans une réaction chimique, il est essentiel de comparer les quantités initiales de chaque réactif avec les quantités nécessaires selon les coefficients stœchiométriques de l'équation chimique équilibrée. Les étapes pour identifier le réactif limitant sont les suivantes :
- Écrire l'équation chimique équilibrée de la réaction.
- Calculer la quantité de produit formé à partir de chaque réactif en utilisant les coefficients stœchiométriques.
- Comparer les quantités de produit formé pour chaque réactif. Le réactif qui produit la plus petite quantité de produit est le réactif limitant.
Il existe plusieurs méthodes de calcul pour déterminer le réactif limitant, la principale étant la comparaison des coefficients stœchiométriques. En examinant les coefficients stœchiométriques de l'équation chimique équilibrée, on peut déterminer le rapport molaire entre les réactifs. Le réactif qui a le rapport molaire le plus faible par rapport à la formation du produit est le réactif limitant. Par exemple, si l'équation chimique équilibrée est :
2 A + 3 B → 4 C
Et que nous avons 6 moles d'A et 8 moles de B, nous pouvons calculer le rapport molaire pour chaque réactif :
- Pour A : 6 moles / 2 = 3 moles de C formées par mole d'A.
- Pour B : 8 moles / 3 = 2,67 moles de C formées par mole de B.
Dans cet exemple, le réactif B produit moins de moles de C par mole que le réactif A, donc le réactif B est le réactif limitant.
Réactions totales et partielles 💥
Avancement final d'une réaction
Définition
Considérons la réaction chimique dont l'équation est: aA + bB ![]() cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stoéchiométriques. Les notations utilisées dans la suite sont résumées ci-dessous:
cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stoéchiométriques. Les notations utilisées dans la suite sont résumées ci-dessous:
- x : avancement de la réaction ;
- n(A)0 : quantité de matière initiale de A ;
- n(A) : quantité de matière de A à la date t ;
- n(A)f : quantité de matière finale de A.
Voici un exemple de tableau d'avancement :
| Équation de la réaction | aA | + | bB | = | cC | + | dD |
|---|---|---|---|---|---|---|---|
| Etat initial (mol) | n(A)0 | + | n(B)0 | = | n(C)0=0 | + | n(D)0=0 |
| Etat à l'instant T (mol) | n(A)=n(A)0-axt | + | n(B)=n(B)0-bxt | = | n(C)=cxt | + | n(D)=dxt |
| Etat à la fin de la réaction (mol) | n(A)f=n(A)0-axf | + | n(B)f=n(B)0-bxf | = | n(C)f=cxf | + | n(D)f=dxf |
Il en est de même pour les autres espèces. L'avancement final est un avancement qui est réellement observé, atteint. Mais l'avancement maximal correspond également à l'avancement atteint lorsqu'un réactif est entièrement consommé. (avancement théorique observable).
Taux d'avancement τ
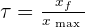
- Si τ ≤ 1 => si τ = 1 xf = xmax alors on est en présence d'une réaction totale
- τ < 1 , xf ≠ xmax alors on est en présence d'une réaction partielle qui s'arrête lorsqu'elle atteint l'équilibre chimique.
Temps de demi-réaction
⌛️ Le temps de demi-réaction est la durée au bout de laquelle l'avancement x est égal à la moitié de l'avancement final.
Si la transformation est totale, ce qui correspond à la disparition du réactif limitant, l'avancement final est l'avancement maximal alors :
Quand t = t 1/2,
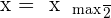
Détermination de t1/2
On calcule xmax à partir du réactif limitant dans le tableau d'avancement. On en déduit: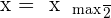
En reportant cette valeur sur la courbe x=f(t) on déduit par simple lecture graphique la valeur de t1/2.
Relation entre l'avancement et la concentration molaire volumique
Si on ne prend en compte que le cas particulier d'une réaction ayant lieu en solution aqueuse telle que le volume V de la solution soit constant, alors on peut utiliser l'expression suivante : [ [X] = frac {n(X)} {V} ] Avec :
- [X] représentant la concentration molaire (en mol.L-1) ;
- n(X) représentant la quantité de matière de l'espèce X en solution (en mol) ;
- V représentant le volume de la solution (en L).
D'après ce qui précède, en divisant tous les termes de la relation de définition de l'avancement par V : 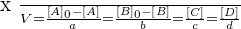
Vitesse volumique de réaction 🏎️
Définition
On peut définir la vitesse volumique de réaction avec l'aide de l'expression suivante : 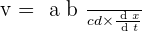 Avec :
Avec :
- v représentant la vitesse volumique de réaction (en mol.m-3.s-1) ;
- V représentant le volume de la solution (en m3) ;
- dx représentant la variation de l'avancement (en mol) ;
- dt représentant la durée de la variation (en s).
Remarques :
- Il arrive fréquemment que le volume V soit exprimé en litre. La vitesse de réaction est alors exprimée en mol.L-1.s-1 ;
- Si la transformation est lente ou très lente la durée peut être exprimée en minute ou en heure. La vitesse de réaction est alors exprimée en mol.L-1.min-1 ou en mol.L-1.h-1 ;
- Le rapport dx/dt représente la dérivée par rapport au temps de l'avancement.
Déterminer la vitesse de réaction

D'après la relation de définition , il faut connaître V et la fonction x=f(t). Cette fonction peut être connue soit :
- Par son graphe (il est donné dans certains exercices) ;
- Par un tableau de mesures présentant les valeurs des couples {ti ; xi} (il est donné dans certains exercices) ;
- A l'aide du tableau d'avancement de la réaction. Il faut alors connaître, soit par une méthode chimique soit par une méthode physique, l'évolution de la concentration de l'un des réactifs ou de l'un des produits de la transformation. Etudier les deux TP de cinétique chimique.
Méthodes de calcul
- Graphiquement : On trace la tangente à la courbe x=f(t) à la date t choisie. La valeur du rapport dx/dt est égal au coefficient directeur de cette tangente ;
- On divise alors cette valeur par la valeur de V (volume de la solution) ;
- Par le calcul: Un tableur calcule directement la vitesse v à partir des valeurs de V, ti et xi.
Évolution de la vitesse de réaction au cours du temps
Au cours du temps les réactifs disparaissent donc leur concentration diminue. Or nous avons déjà vu que la concentration des réactifs est un facteur cinétique. Plus la concentration des réactifs est faible plus la réaction est lente. Donc, en général, au cours du temps la vitesse de réaction diminue.
Le rôle des catalyseurs ⚡️

En chimie, un catalyseur est un élément d'une réaction qui augment la vitesse de réaction.
Chaque catalyseur est propre à une réaction chimique. Par exemple, un catalyseur qui accélère une certaine réaction n'aura pas forcément le même effet sur une autre. De plus, les catalyseurs n'ont pas d'incidence sur les produits de la réaction. on utilise régulièrement comme catalyseur les zéolithes, des composants minéraux de synthèses assez proches de l'argile.
🚗 Leur utilisation la plus courante est dans les pots catalytiques des voitures. Mais on retrouve aussi fréquemment les catalyseurs dans l'industrie et la chimie.
Limites et précautions pour le calcul 🚨
En chimie, et comme beaucoup d'autres domaines, il est essentiel de connaître les limites et précautions à prendre durant la phase de calcul.
Pour la réaction chimique, il s'agit de prendre en compte :
- Les facteurs qui peuvent affecter les résultats dans la réalité, comme l'environnement ou les pertes de réactifs
- L'influence des conditions expérimentales sur la détermination du réactif limitant
- L'importance de la précision dans les mesures

Facteurs qui peuvent affecter les résultats dans la réalité
🚨 Tout d'abord, les réactions chimiques peuvent être influencées par des conditions environnementales telles que :
- La température
- La pression
- La présence de catalyseurs
Des variations dans ces paramètres peuvent modifier la vitesse de la réaction et entraîner des quantités de produit différentes de celles prévues théoriquement.
De plus, les réactifs utilisés dans le laboratoire peuvent présenter une pureté inférieure, ce qui pourrait entraîner des erreurs dans les calculs stœchiométriques. Les pertes de réactifs lors du transfert et de la manipulation peuvent également affecter les résultats.
Enfin, les réactions réversibles et les équilibres chimiques peuvent compliquer l'identification du réactif limitant, car les réactifs peuvent être consommés partiellement et les produits peuvent se transformer en réactifs au cours de la réaction.
Influence des conditions expérimentales sur la détermination du réactif limitant
La détermination du réactif limitant dépend des conditions expérimentales utilisées. Les réactions peuvent être effectuées à différentes températures, concentrations, pressions ou en utilisant des catalyseurs, ce qui peut modifier la vitesse de réaction et donc l'évolution des réactifs et des produits.
Par conséquent, les conditions choisies peuvent affecter la quantité de produit formé et rendre l'identification du réactif limitant plus complexe. Il est donc important de contrôler soigneusement les conditions expérimentales pour obtenir des résultats fiables et reproductibles.
Importance de la précision dans les mesures
🔬 La précision dans les mesures est d'une importance capitale lorsqu'il s'agit de déterminer le réactif limitant. Les erreurs dans les mesures des quantités de réactifs peuvent entraîner des erreurs significatives dans le calcul du réactif limitant et du rendement de la réaction. Il est essentiel d'utiliser des balances et des équipements de mesure de haute qualité et de suivre les protocoles expérimentaux de manière rigoureuse.
Les chimistes doivent également prendre en compte les chiffres significatifs dans leurs calculs pour garantir la précision des résultats. Une approche prudente et précise dans les mesures permet d'obtenir des résultats fiables et cohérents, ce qui est essentiel pour interpréter correctement les résultats expérimentaux et pour réaliser des réactions chimiques avec succès.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
merci infiniment
bonjour,
j’ai une question qui me perturbe sur les réactions complètes et incomplètes.
J’ai appris que les réactions complètes étaient caractérisées soit par des réactifs dans les proportions stoechiométriques qui disparaissaient totalement ou bien, si les réactifs ne sont pas dans les condition sstoechiométriques, il y a le réactif limitant qui disparaissait complètement. Et pour les réactions incomplètes, les réactifs doivent etre dans les proportions stoechiométriques et aucun des réactifs a réagi complètent. Cependant, j’ai rencontrré des exercices ou il y avait un réactif limitant dans une réaction incomplète. Existe t il des réactions incomplètes (ou les réactifs qui ne sont pas dans les PS) ou il y a un réactif limitant c’est à dire qui disparait complètement???? je vous remercie de m’éclaircir ce point
Bonsoir quand est ce qu’on calcul le réactif limitant
Bonjour comment calculer la masse n’est pas reagit du reactif en excès
Bonjour,
Dans le cas de réactifs introduits dans des proportions stroerchiométriques, sont-ils également considérés comme limitants (à la fin de la réaction ils n’en restent plus)?
Bonjour, je reprends mes vieux cours de chimie.
Au niveau de la dégénérescence de l’ordre (cinétique chimique) j’ai un trou
“but simplifier la loi de vitesse v=k[A]^P[B]q
Si [B] est en large excès par rapport à [A], alors …. ?
Merci
comment calculer la masse du reste du réactif en excès ?
Bonjour,
Nous ne faisons pas leurs devoirs à la place des élèves, mais si vous avez besoin d’une aide personnalisée, vous pouvez contacter l’un de nos professeurs 🙂