Chapitres
- 01. Échanges d'énergie thermique
- 02. Les lois de la thermodynamiques
- 03. Variation de température lors d'un échange d'énergie
- 04. Le changement d'état est une transformation physique
- 05. Les changements d'états de l'eau
- 06. L'eau et ses différents états
- 07. Changement d'état lors d'un échange d'énergie
- 08. Le calorimètre

Échanges d'énergie thermique

Ce qu'on appelle transfert thermique en sciences est plus couramment appelé chaleur dans la vie quotidienne. Un transfert thermique correspond à l'un des modes d'échange d'énergie thermique entre deux systèmes. Dans le cas du double vitrage, on parlera du système extérieur et du système intérieur (la maison). Cela correspond à une notion fondamentale de la thermodynamique et, contrairement au travail, les transferts thermiques correspondent à un bilan de transferts d'énergie dits microscopiques et désordonnées.
Il est possible de distinguer trois type de transfert thermique, tous pouvant coexister :
- La conduction correspond à la diffusion progressive de l'agitation thermique dans la matière ;
- La convection correspond au transfert thermique qui accompagne des déplacements macroscopiques de la matières ;
- Et le rayonnement qui correspond à la propagation de photons.
Ainsi, la quantité de chaleur, notée Q et exprimée en joule, correspond à la quantité d'énergie qui sera échangée par le moyen de ces trois différents type de transfert. Une convention indique alors que, lorsque Q > 0, on dit que le système reçoit de l'énergie. De plus, il peut être intéressant de retenir que la thermodynamique fait appel au concept de chaleur afin de mettre en place le premier mais aussi de deuxième principe de la thermodynamique.
Malgré tout cela, il reste de nombreuses ambiguïtés mais également de nombreuses confusions qui s'entretiennent. En effet, malgré le sens que l'on accorde à chaleur dans la vie quotidienne, le principe de chaleur au sens thermodynamique du mot n'a aucun lien avec la température. Cependant, il reste vrai que les transferts thermiques spontanées se font toujours du système le plus élevé en température vers le système le moins élevé en température même s'il reste possible de provoquer l'inverse grâce à une machine thermique comme un réfrigérateur.
Il est d'ailleurs intéressant de noter que, lorsqu'il y a un changement d'état, le corps pur ne changera pas de température bien qu'il échange de l'énergie sous forme de chaleur.
La thermochimie
La thermochimie correspond à une branche de la physique chimie et permet l'étude des différents phénomènes thermiques dans des milieux réactionnels. On peut positionner cette branche, sur le plan disciplinaire, à l'interface entre la chimie et la thermodynamique.
En chimie, il existe différents types de réactions : les réactions dites exothermiques et qui dégagent donc de la chaleur et les réactions dites endothermiques qui, quant à elles, absorbent la chaleur. Il est possible de déterminer et mesurer les chaleurs de réactions par calorimétrie à pression constante dans un calorimètre ou encore à volume constant dans une bombe calorimétrique.
La bombe calorimétrique, inventée en 1881 par Marcellin Berthelot, est un outil permettant de mesurer le pouvoir calorifique d'une combustible. C'est pour cela que Marcellin Berthelot est considéré comme étant le fondateur de la thermochimie. Même s'il faudra attendre le XXe siècle que la thermochimie se développera considérablement.
En appliquant le deuxième principe de la thermodynamique aux systèmes chimiques, il est possible de prévoir le sens des réactions mais aussi le positionnement des équilibres chimiques et ainsi de définir le rendement et la composition d'un système après la réaction.
Chaleur de réaction
Au cours d'une réaction chimique, on dit que le système échange de l'énergie avec le milieu extérieur. Cet échange se fait sous la forme de transfert thermique, anciennement appelé chaleur.
Cette énergie échangée sous forme de transfert thermique Q dépend des conditions expérimentales dans lesquelles se produit la réaction :
- Volume constant, on parle d'une transformation isochore, la thermodynamique montre que Q est égale à la variation d'énergie interne du système. On peut alors noter Qv = ΔU (c'est notamment le cas de la bombe calorimétrique)
- Pression constante, la chaleur est égale à la variation d’enthalpie : Qp = ΔH (ce qui représente le cas très fréquent des réactions effectuées à l’air libre).
La chaleur est décrite comme quelque chose qui est chaud, la définition du Larousse donne d’ailleurs : qualité de ce qui est chaud, température, sensation que donne un corps chaud.
En physique, il s’agit d’un mode de transfert d’énergie d’un corps à l’autre (et ne correspondant pas à un travail). La thermodynamique est d’ailleurs la science qui étudie tous les phénomènes liés à la chaleur.
Enthalpie libre
Pour tout système thermodynamique, il est défini une fonction d'état appelée enthalpie libre ou encore énergie de Gibbs. Cette fonction, notée G, est telle que G = H - TS avec :
- H l'enthalpie en joules ;
- T la température en kelvin ;
- et S l'entropie en J.K-1.
Cette fonction d'enthalpie libre est une fonction d'état considérée comme indispensable pour l'étude des équilibres chimiques. En effet, cette fonction ne peut que décroître dans le cas d'une transformation à pression et température constantes selon le deuxième principe de la thermodynamique. Cela permet donc, dans le cas d'une réaction chimique effectuée à T et P constantes, d'avoir le signe de l'enthalpie libre de réaction qui indique le sens dans lequel se déplace l'équilibre chimique. Ainsi, lorsque l'enthalpie libre atteint un minimum et donc qu'elle ne varie plus, alors l'équilibre chimique est atteint.
Energie thermique
Pour être plus précis, les physiciens ne parlent pas de chaleur mais d’énergie thermique.
L’énergie thermique échangée par un corps est notée avec la lettre Q et exprimée en Joule ou en kilojoule. Lorsqu’un corps reçoit de l’énergie thermique celle-ci est notée positive alors que s’il en cède elle est notée négative.
Par ailleurs, étant donnée que l’énergie se conserve, si un corps n°1 reçoit une énergie Q1 de la part d’un corps n°2 qui échange une énergie Q2 alors Q1 = -Q2 : les énergies échangées par les deux corps ont la même valeur absolue mais des signes opposés.
Les lois de la thermodynamiques

Il est important de noter que le premier et le deuxième principe de la thermodynamique sont les plus importants, mais il peut tout de même intéressant de connaître les deux autres.
Le principe zéro de la thermodynamique
Ce principe concerne la notion d'équilibre thermique. Ainsi, il est à la base de la thermométrie et s'énonce ainsi : si deux systèmes sont en équilibre thermique avec un troisième, alors ils sont aussi ensemble en équilibre thermique.
Le premier principe de la thermodynamique
Egalement appelé principe de la conservation de l'énergie, ce principe affirme que l'énergie est toujours conservée. Formulé autrement, cela signifie que l'énergie totale d'un système isolé reste constante. Ainsi, les événements qui se produisent au sein du système isolé ne se traduisent donc que par des transformations de certaines formes d'énergie en d'autres formes d'énergie. Puisque l'énergie ne peut pas être produite en partant de rien, elle est présente en quantité invariable dans la nature. Elle ne peut donc que se transmettre d'un système à un autre : on ne crée par l'énergie, on la transforme.
Ce principe est également considéré comme étant une loi générale pour toutes les théories physiques, notamment en mécanique, électromagnétisme ou physique nucléaire puisqu'on ne lui a jamais trouvé la moindre exception même si des doutes peuvent subsister lorsque l'on étudie les désintégration radioactives.
De puis le théorème de Noether, on sait que la conservation de l'énergie est intimement reliée à une uniformité de structure de l'espace-temps.
Le premier principe de la thermodynamique rejoint alors le célèbre principe popularisé par Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme."
Le deuxième principe de la thermodynamique
Egalement appelé principe d'évolution des système, ce principe affirme la dégradation de l'énergie. En effet, l'énergie d'un système passe de façon nécessaire et spontanée de formes concentrées et potentielles à des formes diffuses et cinétiques telles que le frottement ou la chaleur.
Ce principe introduit donc également la notion d'irréversibilité d'une transformation et la notion d'entropie. En effet, d'après le deuxième principe de la thermodynamique, l'entropie d'un système isolé augmente ou reste constante. Souvent interprété comme une mesure du désordre et comme l'impossibilité du passage du désordre à l'ordre sans intervention extérieur.
L'interprétation de ce principe se base sur la théorie de l'information de Claude Shannon et la mesure de cette information, également appelée entropie de Shannon.
La principale différence de ce principe avec le premier principe de la thermodynamique est l'origine statique de ce deuxième principe. En effet, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statique. Cependant, le deuxième principe de la thermodynamique reste relativement indépendant des caractéristique des lois précédemment citée puisqu'il apparaît même si l'on suppose des lois simplistes à petite échelle.
Le troisième principe de la thermodynamique
Ce principe, quant à lui, est associé à la descente vers un état quantique fondamental d'un système dont la température s'approche d'une limite qui définit la notion de zéro absolu. En effet, en thermodynamique classique, ce principe permet de calculer l'entropie molaire S d'un corps pur par intégration sur la température à partir de S=0 à 0 K dans le but d'établir des tables de données thermodynamiques.
Laplace en thermodynamique
En thermodynamique, cette loi correspond à une relation reliant la pression et le volume d'un gaz parfait qui subit une transformation dite isentropique ou une transformation dite adiabatique et réversible. Mais cette relation peut également être utilisée avec la température et le volume ainsi que la température et la pression.
La loi de Laplace suppose en effet des capacités thermiques constante alors que les capacités thermiques d'un gaz parfait dépend évidemment de la température, il suffit de regarder la loi des gaz parfait. En conséquence, cette loi ne peut être appliquée à des transformation où la variation de la température est peu important. On peut alors considérer que les capacités thermiques sont constantes.
\[ P \times V = n \times R \times T \]
Avec :
- P est la pression d'un gaz (en pascals),
- V le volume occupé par le gaz (en m3),
- n la quantité de matière (en moles),
- R la constante universelle des gaz parfaits (8,3144621 J/K/mol)
- Et T est la température (en kelvins).
Variation de température lors d'un échange d'énergie
Unités de température
On peut utiliser plusieurs échelles de températures. Parmi les plus connues on note :
- Le degré Kelvin : c’est l’unité internationale qui est utilisée en thermodynamique. Son nom vient du physicien Lord Kelvin. Le zéro du degré kelvin est définit comme le point ou il ne règne aucune agitation thermique.
- Le degré Celsius : son nom provient du physicien suédois Anders Celsius et son unité est exprimée en °C. En degré celsius l’eau se transforme en glace à 0°C. C’est l’unité qui est utilisée en France pour nommer les températures.
- Le degré Fahrenheit : est une unité de mesure utilisée principalement aux Etats-Unis. Son nom vient du physicien allemand Daniel Gabriel Fahrenheit.
Comment passer d’une température en Celsius en température Fahrenheit ou Kelvin ?

Pour passer des degrés Celsius aux degrés Fahrenheit, on doit multiplier par 1,8 la température et y ajouter 32. Pour passer des degrés Celsius aux degrés Kelvin, on doit ajouter aux degrés Celsius 273,15.
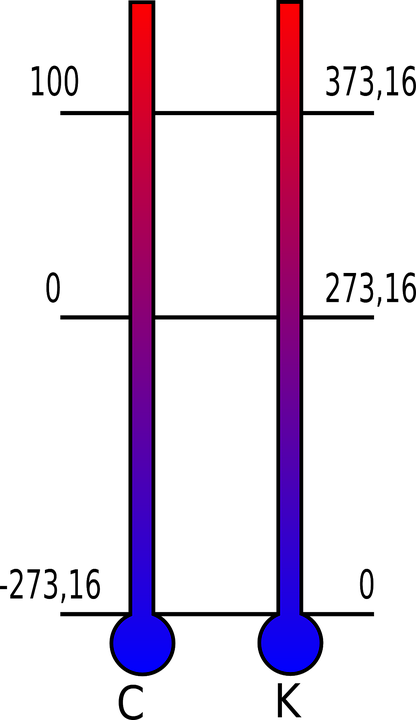
Note : il existe d’autres échelles de température moins connues comme par exemple les degrés Centigrades ou les degrés Rankines.
Variation de température
La variation de température d'un corps de masse m qui échange de l'énergie thermique peut être exprimée avec la relation suivante : 
- Q est l'énergie thermique échangée exprimée en joule ( J )
- m est la masse du corps exprimée en kilogramme ( kg )
- Cm est une grandeur appelée capacité thermique massique dépendant de la nature du corp. Cm est exprimée en Joule par degré celcius par kilogramme ( J.C-1.kg-1)
- Tf correspond à la température finale après l'échange d'énergie exprimée en degré celcius ( °C )
- Ti correspond à la température initiale avant l'échange d'énergie exprimée en degré celcius ( °C )
Remarques :
- Si le corps reçoit de l'énergie thermique alors Q>0 dont Tf - Ti >0 ce qui signifie que la température augmente alors que si un corps perd de l'énergie thermique Q<0 donc Tf-Ti<0 ce qui correspond à une baisse de température
- Cette formule peut aussi être utilisée pour prévoir la température finale d'un corps lorsqu'on connait la valeur de l'énergie thermique échangée. Il suffit de modifier la formule pour obtenir :

Qu’est ce que la capacité thermique massique ?
La capacité thermique massique ou capacité thermique spécifique a longtemps été nommée « chaleur massique » ou encore « chaleur spécifique ». Il s’agit d’une valeur qui s’exprime en J/kg-1/K-1.
C’est la capacité d’un matériau à accumuler de l’énergie sous forme thermique, en fonction de sa masse pour une température donnée.
Le tableau ci-après regroupe quelques capacités thermiques massiques :
| Matériaux | Capacité thermique massique |
|---|---|
| Aluminium | 881 |
| Acier | 470 |
| Eau liquide | 4185 |
| Fer | 444 |
| Asphalte | 1021 |
| Sable | 835 |
| Verre | 720 |
Le changement d'état est une transformation physique
On appelle transformation physique tout passage d'un ou de plusieurs corps d'une forme à l'autre et ce sans qu'il n'y ait de modification de la structure moléculaire voire nucléaire des constituants des corps qui subissent la transformation. Ainsi, une transformation physique peut être représenté par un changement d'état de la matière, les déformations ou encore des ruptures suite à l'action de la température ou de la pression.
Les changements d'états de l'eau

Il existe en tout 6 changements d'états possibles pour l'eau. Ce sont les six transformations fondamentales qui interviennent en chimie.
La fusion
La fusion intervient lorsque de la glace fond. Par exemple, un glaçon dans un verre d'eau. Il s'agit donc du passage de l'état solide à l'état liquide.
La vaporisation
La vaporisation est le passage de l'état liquide à l'état gazeux. Même si le nom est proche, cela n'a aucun rapport avec le fait de projeter de l'eau avec un vaporisateur. La vaporisation a lieu lorsqu'on laisse évaporer de l'eau au soleil ou quand on la porte à ébullition.
La liquéfaction
Il s'agit de la transformation inverse de la vaporisation. Elle intervient quand de la vapeur d'eau se transforme en eau liquide. La liquéfaction a lieu soit par compression : la pression qui augmente rends l'eau gazeuse liquide ou par refroidissement et dans ce cas le gaz refroidit pour devenir liquide, c'est la condensation.
La solidification
La solidification est le phénomène durant lequel l'eau liquide devient solide. Cela se produit quand elle gèle, on parle alors de congélation. L'eau se met à se solidifier une fois qu'elle descend en dessous de 0° C. L'eau peut aussi se solidifier en cas de cristallisation ou d'augmentation de la pression.
La sublimation
La sublimation intervient quand l'eau passe directement de l'état solide à l'état gazeux. Cela fait que la glace devient vapeur sans même passer par les étapes habituelles de fusion et de vaporisation. Cela peut arriver lorsque de l'eau très chaude entre en contact avec de l'air très froid. Elle part alors en fumée blanche (de la vapeur d'eau).
La condensation solide
La condensation solide est le phénomène qui se produit lorsque de l'eau sous forme de vapeur vient toucher une surface très froide. Par exemple, si l'on souffle sur une vitre gelée, la vapeur d'eau contenue dans notre respiration gèlera instantanément en se transformant en eau solide.
L'eau et ses différents états
L'eau peut se trouver sous ses 3 états à la surface de la Terre. En effet, elle est liquide dans nos rivières et lorsqu'on la boit, gazeuse dans l'air que nous respirons et dans la vapeur d'eau et pour finir solide sur les glaciers ou dans les glaçons.
Les précipitations et leurs états
Toutes les précipitations que nous subissons à la surface de la Terre ne présentent pas d'états identiques. En effet, dans certains cas il s'agit de précipitations solides et dans d'autres il s'agit de précipitations liquides.
La pluie
C'est un phénomène qui se forme à partir des gouttelettes contenues dans les nuages ou des cristaux de glaces qui ne sont pas assez froids pour rester congelés lors de leur chute. Il existe plusieurs formes de pluies : la bruine qui est caractérisée quand les gouttes d'eau mesurent moins de 1,5 mm ; la pluie verglaçante qui se forme quand les conditions de pression et température du sol sont inférieures au point de congélation alors que ce n'était pas le cas dans l'atmosphère.
La grêle
Elle est représentée par des billes de glace mesurant de 5 à 50 mm même si parfois ces billes, appelées grêlons, peuvent atteindre la taille d'une balle de tennis. Leur vitesse de chute monte jusqu'à 160 km/h, ce qui cause de nombreux dégâts.
La neige
Les conditions pour l’apparition de neige sont très particulières. De la vapeur se transforme en cristaux de glace et ces derniers doivent s'assembler rapidement pour former des flocons. Ce procédé à lieu à des températures qui permettent d'éviter la fonte du flocon durant sa chute. En moyenne, il neige entre -3°C et 3°C.
Le grésil
Il est composé de grêlons qui sont devenus liquides durant leur chute mais se remettent à geler une fois entrés dans la masse d'air froide inférieure à 0°C. Son cœur reste donc liquide et son enveloppe solide.
L'eau solide
L'eau atteint son état solide lorsque la température atteint ou descend les 0° C. Les molécules adoptent donc une structure cristalline.
L'eau liquide
On peut trouver de l'eau liquide dans les conditions climatiques habituelles de nos environnements de vie. En effet, sous pression atmosphérique normale de 1 bar et entre 0° C et 100° C, l'eau prend sa forme liquide. Elle adopte alors une structure plus désordonnée et prends moins de place. C'est pourquoi l'eau gelée occupe plus de place que l'eau liquide.
L'eau gazeuse
La majorité de l'eau gazeuse est celle que nous respirons dans l'air. A pression normale de 1 bar et une fois passé la barre des 100° C, l'eau devient gazeuse et l'on parle alors de vapeur d'eau. C'est aussi l'état de l'eau qui s'évapore (au-dessus des lacs, rivières ou océans). Les molécules d'eau sont dans leur état le plus agité lorsqu'elles sont gazeuses. L'attraction terrestre s'exerce alors moins dessus et permet au gaz de expanser.
Changement d'état lors d'un échange d'énergie
Rappel sur les changements d’état
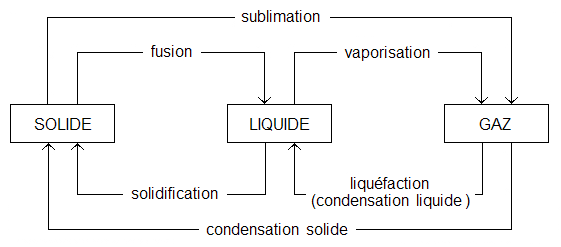
Il arrive qu’un transfert d’énergie thermique fasse changer l’état d’un corps. Un corps peut se trouver sous 3 états différents : l’état liquide, l’état solide et l’état gazeux. Chaque changement d’état porte un nom bien précis :
- Le passage de l’état solide à l’état liquide se nomme la fusion et à l’inverse, le passage de l’état liquide à l’état solide se nomme la solidification.
- Le passage de l’état gazeux à l’état solide se nomme la condensation et à l’inverse le passage de l’état solide à l’état gazeux se nomme la sublimation.
- Le passage de l’état liquide à l’état gazeux se nomme se nomme la vaporisation et à l’inverse le passage de l’état gazeux à l’état liquide se nomme liquéfaction.
Les changements d’états sont résumés dans l’image qui suit :
Lien entre le transfert et la masse : Lorsqu’un corps pur change d’état, sa température ne varie pas tant que le changement n’est pas terminé. La chaleur nécessaire à un changement d’état d’un corps de masse m dépend de cette masse ainsi que d’une grandeur notée Lm et appelée énergie massique de changement d’état et elle peut être calculée grâce à la relation suivante: 
- Q est l’énergie thermique échangée pendant un changement d’état exprimée en joule ( J)
- m est la masse du corps exprimée en kilogramme ( kg )
- L est l’énergie massique de changement d’état exprimée en joules par kilogramme ( J.kg-1)
Qu’est ce que Lm ou énergie massique de changement d’état ?
Cette énergie est aussi appelée chaleur latente. Voici 2 exemples :
1. Changement d'état entre un liquide et un solide : fusion-solidification
Si on place un corps solide et qu'on le chauffe jusqu'à l'amener à l'état liquide, on effectue une fusion. Durant la transformation, la température reste constante et est égale à la température de fusion (Tf) du corps en question. La chaleur Q qu'il a fallu fournir est proportionnelle à la masse m transformée et suit bien l'équation :  Avec Q énergie thermique en Joules, m la masse en kilogrammes et Lf la chaleur latente de fusion exprimée en joules par kg. La température de fusion dépend surtout de la nature du corps que l'on a utilisé et non des conditions expérimentales. La température de fusion exprime donc la quantité de chaleur qu'il faut fournir à une masse d'un corps pour l'amener entièrement à l'état liquide. Note : la chaleur cédée au milieu par une masse qui se solidifie vaut
Avec Q énergie thermique en Joules, m la masse en kilogrammes et Lf la chaleur latente de fusion exprimée en joules par kg. La température de fusion dépend surtout de la nature du corps que l'on a utilisé et non des conditions expérimentales. La température de fusion exprime donc la quantité de chaleur qu'il faut fournir à une masse d'un corps pour l'amener entièrement à l'état liquide. Note : la chaleur cédée au milieu par une masse qui se solidifie vaut 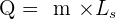 Avec Ls = -Lf avec Ls qui désigne la température de solidification. Quelques exemples de chaleur de fusion et de température de fusion :
Avec Ls = -Lf avec Ls qui désigne la température de solidification. Quelques exemples de chaleur de fusion et de température de fusion :
- Aluminium : chaleur de fusion de 330 kJ.kg-1 et température de fusion de 660°C
- Dioxyde de carbone : chaleur de fusion de 184 kJ.kg-1 et température de fusion de -56,6°C
- Soufre : chaleur de fusion de 41,8 kJ.kg-1 et température de fusion de 115°C
- Mercure : chaleur de fusion de 11,5 kJ.kg-1 et température de fusion de -38,87°C
2. Changement d'état entre un liquide et un solide : vaporisation-condensation
La vaporisation désigne le passage d'un corps de l'état liquide à l'état gazeux. Ce type de transformation peut s'effectuer de différentes manières comme par exemple l'évaporation d'un liquide laissé à l'air libre ou ébullition d'un liquide. La chaleur latente de vaporisation Lv d'un corps à un température constante désigne la quantité de chaleur qu'il faut fournir à une unité de masse de ce corps pour le transformer entièrement en vapeur. Ce changement d'état est noté comme tel : 
- Avec Q énergie thermique en Joules,
- m la masse en kilogrammes
- Et Lv la chaleur latente de vaporisation exprimée en joules par kg.
A noter : la quantité de chaleur cédées au milieu extérieur par une masse m de gaz quand elle se condense à température constante équivault à : 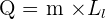 Et Ll = Lv avec Ll qui désigne la température de solidification. Quelques exemples de chaleur de vaporisation et de température ou point d'ébullition :
Et Ll = Lv avec Ll qui désigne la température de solidification. Quelques exemples de chaleur de vaporisation et de température ou point d'ébullition :
- Ammoniac : chaleur de vaporisation de 1376 kJ.kg-1 et température d’ébullition de -33,35 °C
- Éthanol : chaleur de vaporisation de 906 kJ.kg-1 et température d'ébullition de 78°C
- Dioxygène : chaleur de vaporisation de 212,5 kJ.kg-1 et température d'ébullition de -182,9°C
- Hélium : chaleur de vaporisation de 20 kJ.kg-1 et température d'ébullition de -268,9°
Applications : on peut étudier le pouvoir calorifique d'un combustible pour savoir la quantité de chaleur obtenue par la combustion d'un kilogramme de ce combustible. Par exemple le bois à un pouvoir calorifique de 17500 kJ.kg-1 alors que le gaz naturel a un pouvoir calorifique de 37600 kJ.kg-1.
Le calorimètre
Lorsque l'on souhaite mesurer des échanges thermiques, les corps étudiés doivent être isolés, afin que l'énergie thermique ne soit pas communiquée à l'air, aux récipients et aux autres éléments. On utilise alors un appareil appelé calorimètre qui permet non pas de supprimer totalement les échanges d'énergie avec l'extérieur mais permet de les limiter et les rend évaluables (un calorimètre possède une capacité thermique qui est connue ou qui peut être mesurée).























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Un corps de-10° à 100°c à 1 bar.
Bonjour! Lors d’une fusion, le matériau absorbe ou libéré de l’énergie ?
Bonsoir s’il vous plaît j’aimerais les différentes quantités de chaleur pour le passage de l’eau de l’état solide à la vapeur
Bonjour, faut il autant d’énergie pour augmenter la température d’un litre d’eau à chaque degré supplémentaire. Merci
Je vous félicite pour ce beau travail vous effectuez je veux que nous m’aider à mieux comprendre le physique
Si il y a un transfert thermique cest le chaud ou le froid qui vas ceder
La source chaude céde son énergie à la source froide dans le cas d’une évolution spontanée pour plus de détail tu peux te renseigner sur la loi empirique de Fourier jth = -lamba grad (T).
Où jth est le vecteur densité de courant thermique, lambda est la conductivité thermique, T est la température
Bonjour!
Peut-on changer la température d’un système sans lui apporter de la chaleur? Justifiez votre réponse