Chapitres

Utiliser les propriétés d'une espèce chimique pour l'identifier
Rappel : tous les corps purs peuvent se trouver sous trois états : solide, liquide ou gazeux. Ces corps peuvent passer d’un état à un autre en fonction des conditions de température et de pression. Chaque espèce chimique est caractérisée par des propriétés qui lui sont propres et permettent donc de la distinguer des autres. Ces propriétés peuvent être utilisées pour identifier une espèce chimique à plusieurs occasions :
- Pour déterminer la nature d’une substance chimique inconnue.
- Pour vérifier la nature d’une substance chimique extraite d’un mélange.
- Pour vérifier la nature d’une substance chimique obtenue lors d’une synthèse chimique.
Exemple de propriétés utilisées pour l’identification d’une espèce chimique :
La température de fusion (pour les solides)
La température de fusion est la température pour laquelle une substance passe de l’état solide à l’état liquide. Cette température est notée Tf mais peut aussi être notée Tfus ou encore θfus. On peut également noter le nom du corps entre parenthèses. La température de fusion est propre à chaque corps. Elle est utilisée pour vérifier la pureté d’un corps. En effet, pour chaque substance, le point de fusion est connu. Si ce point de fusion diminue, cela peut révéler la présence d’impuretés dans la substance. Pour étudier la température de fusion, il y a trois caractéristiques à retenir :
- La température de fusion est utilisable pour un corps pur
- La température de fusion n’est pas applicable aux solides qui ne peuvent pas passer à l’état liquide
- La température de fusion est fonction de la pression
Le point de fusion peut se mesure grâce à l’utilisation d’un banc de Kofler. Comment mesure t-on la température de fusion avec un banc de Köfler ? Le banc de Köfler est une table chauffante et graduée. Il s’agit d’un banc chauffé par des résistances. La chaleur est répartie non uniformément selon un gradient de chauffage de sorte qu’il existe une partie froide et une partie plus chaude. Deux corps purs sont utilisés pour étalonner le banc, on fait avancer les substances sous forme de poudre jusqu'à la fusion et on regarde ensuite la graduation. Quelques températures de fusion :
- Hélium : -272,2 °C
- Mercure : -38,8°C
- Eau : 0°C
- Plomb : 327,5°C
- Or : 1064
- Uranium : 1132
- Fer : 1538
- Tungstène: 3422
La température de solidification (pour les liquides)
La température de solidification est la température pour laquelle il y a un passage de l’état liquide à l’état solide. Souvent, un refroidissement léger permet de faire passer un liquide à l’état de solide. Pour exemple, la solidification de l’eau pure est de 0°C.
La température d’ébullition (pour les liquides)
Il s’agit de la température pour laquelle les substances liquides deviennent gazeuses. Le point d’ébullition est fonction de la pression. Cette température permet l’identification de substances pures. Quelques températures d’ébullition :
- Mercure : 356 °C
- Eau : 100°C
- Fer : 2750°C
- Or : 3080°C
- Plomb : 1740°C
- Tungstène: 5660°C
Point de condensation (pour les gaz)
Il s’agit de la température ou un gaz devient liquide. Note : la température d’ébullition et le point de condensation sont identiques.
| Espèce chimique | Température de Fusion | Température d'ébullition |
|---|---|---|
| Eau | 0°C | 100°C |
| Mercure | -38,8°C | 356°C |
| Plomb | 327,5°C | 1740°C |
| Fer | 1538°C | 2750°C |
La masse volumique
La masse volumique d’une espèce est la masse par unité de volume. Le rapport entre la masse et le volume permet d’identifier une substance. Elle se définit ainsi :

Avec :
- m la masse en kg
- et V, le volume exprimé en m3.
La masse volumique dépend de la pression et de la température. Elle permet de comparer les matériaux ensemble par exemple de savoir si un matériau va flotter.
La densité
La densité est définie par le rapport de la masse volumique du solide ou du liquide par celle de l’eau pure prise à une température de référence de 3,98°C soit 1000kl/L. Ce rapport fait intervenir deux grandeurs qui possèdent les mêmes unités, ainsi la densité n’a pas d’unité.
Miscibilité
C’est la capacité pour deux espèces de pouvoir se mélanger. Certaines espèces ont ainsi plus d’affinité pour un solvant. Rappel : un solvant est une substance (le plus souvent liquide) ayant le pouvoir de dissoudre d’autres substances.
Utiliser les propriétés d'une substance pour vérifier sa pureté
Une substance est rarement totalement pure car il subsiste souvent soit des traces de substances issues du même mélange et éventuellement de petites quantités de solvants d’extraction soit des réactifs qui ont permis de la synthétiser. Plus les quantités d’impuretés sont importantes et plus les propriétés (telles que densité ou température de changement d’état) s’éloignent de celle du corps pur (par exemple plus une eau comporte de sel et plus sa température de solidification est faible). Dans ce cas les propriétés d’une substance peuvent être utilisées pour estimer son degré de pureté. D’autres méthodes permettent de contrôler la pureté d’un mélange: parmi elles, on peut citer la chromatographie, la mesure de l’indice de réfraction, la recristallisation. Chromatographie sur colonne : il s'agit d'une colonne ou sont déposées des composés qui ont une affinité particulière. Cela se nomme la phase stationnaire. Le mélange à purifier est versé dans la colonne. Si les composés du mélange ont une forte affinité avec la phase stationnaire, ceux ci "s'accrochent" aux composés sur la colonne : on récupère ainsi un mélange purifié. Parmi les chromatographies sur colonne les plus connues on peut citer les chromatographies échangeuses de cations (ions chargés positivement) et les chromatographies échangeuses d'anions (ions chargés négativement). Indice de réfraction : cette méthode appelée réfractométrie est basée sur le calcul de l'indice de réfraction. L'indice de réfraction est une valeur sans grandeur qui caractérise la vitesse de la lumière dans une solution. Cet indice est un indicateur de pureté d'une solution. Recristallisation : il s'agit d'une technique ou on solubilise à chaud un composé solide qui contient des impuretés dans une faible quantité de solvant. En solubilisant le mélange à chaud , le produit à purifier et les impuretés passent en solution, en refroidissant le mélange le produit à purifier recristallise alors que les impuretés restent en solution. Note : on parle de corps pur quand une substance n’est constituée que d’un seul élément, sinon on parle de mélange. Application : Quand on fait des réactions de synthèse, il faut s’assurer ensuite que le produit final est exempt de toute impureté. Il faut donc pouvoir compter sur des méthodes qui permettent d’identifier les substances présentes dans un mélange ou qui permettent de contrôler la pureté d’un mélange. Si le produit n’est pas pur, il faudra alors procéder à une purification.
Utiliser les propriétés d'une espèce chimique pour l'extraire d'un mélange
De nombreuses techniques de séparation et d’extraction exploitent les propriétés des espèces chimiques.
La distillation
La distillation est une technique basée sur l’évaporation. Elle utilise donc les températures d’ébullition. Dans une distillation, le composé le plus volatile s’évapore en premier. Ainsi, si on utilise la distillation avec un mélange de liquides, on peut les séparer selon leurs températures d’ébullition. La distillation peut même servir à purifier un mélange. Principe :on utilise un ballon à distiller qui permet de chauffer un mélange de liquides. Quand on chauffe le mélange, le liquide le plus volatile (c'est-à-dire le liquide qui possède la température d’ébullition la plus basse) s’évapore en premier. Les vapeurs sont ensuite condensées à l’aide d’un réfrigérant et forment le distillat qui lui est récupéré dans un autre ballon.
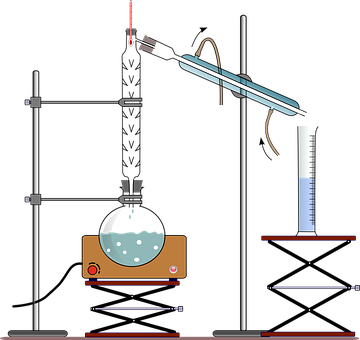
L’extraction
La différence de solubilité d’une substance dans des solvants différents permet de réaliser une extraction liquide – liquide. L’extraction permet donc d’extraire une espèce chimique d’un mélange. Contrairement à la distillation, il n’y a pas de changement de phase. C’est une méthode très ancienne pour étudier un mélange. Note : il existe de nombreuses autres méthodes d’extraction comme par exemple la décoction, l’infusion, la macération ou encore le pressage.

La décantation
Si on veut séparer deux phases liquides non miscibles, on peut procéder à une décantation. Cette méthode est basée sur le fait que les substances d’un mélange n’ont pas la même densité. On peut donc séparer les substances grâce à une ampoule à décanter. On place le mélange à séparer dans l'ampoule, on procède à une agitation et ensuite on laisse les deux substances se séparer. Les phases à décanter se placent de bas en haut de la plus grande densité à la plus petite : la phase la plus dense est toujours placée en dessous. On peut connaître l’ordre des substances si on connaît leur densité. Cependant, si le mélange contient des impuretés, alors les densités peuvent varier. L'élution se fait ensuite simplement par gravité.
























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Bonjour je suis en présence d’une poudre en brûlant elle se liquéfie juste après elle redevient une poudre .
Je sais pas comment appel ça !
Bonjour, avez-vous essayé de contacter l’un de nos professeurs pour recevoir une aide personnalisée ? Excellente journée ! 🙂
Bonjour , pourqoui mesurer les especes chimiques dàs les différents milieux ?
Bonjour , comment peut-on vérifier la pureté d’un liquide récupéré lors d’une distillation à l’aide des températures d’ébullition ? Merci
Bonjour, comment sait on si l’élément étudié est un solide ou bien un liquide ?
Bonjour, pour différencier les deux, il suffit de connaître les propriétés d’un seul. L’élément solide possède une forme propre, et un volume propre, rarement compressible. Ce même volume ne dépend quasiment que de la température par effet de dilatation thermique.
Bonne journée.
Svp quels sont les propriétés qui permettent de vérifier la pureté d’un corps en général ?
Bonjour .comment peut -on fait déffirence entre l’espèce et la substance chimique ?
Bonjour ! Un corps pur est un matériau constitué d’une seule espèce chimique, contrairement au mélange qui en comporte plusieurs.
Bonne journée