Chapitres

Qu'est-ce que la solubilité ?
Définition de la solubilité
La solubilité reflète la capacité d’une espèce chimique à se dissoudre dans un solvant donné : plus on peut dissoudre une quantité importante d’une substance dans un liquide et plus sa solubilité est grande. Cette solubilité peut être quantifiée : elle correspond à la concentration (massique ou molaire) d’un solution saturée c’est à dire d’une solution où a été dissous le maximum de soluté. La solubilité d’une espèce chimique est souvent exprimée en g.L-1 : il s’agit de la masse maximale d’une espèce chimique dissoute dans un volume donné à température donnée. Quelques exemples :
- Solubilité du sel dans l’eau : 360 g.L-1
- Solubilité du sel dans l’éthanol : 0,65 g.kg-1
On peut remarquer une différence notable de solubilité en fonction du solvant utilisé. Les valeurs indiquées dans les exemples précédents indiquent que le sel est soluble dans l’eau (puisqu’il est de 360g.L-1) et pratiquement insoluble dans l’éthanol (0.65g.L-1).
- Solubilité du diiode dans l’eau : 330 mg.L-1
- Solubilité du diiode dans le cyclohexane : 28g.L-1
Les valeurs indiquées dans les exemples précédents indiquent que le sel est soluble dans l’eau et pratiquement insoluble dans l’éthanol. Le diiode est quant à lui quasiment peu soluble dans l’eau mais soluble dans le cyclohexane. Le tableau ci-après regroupe quelques exemples de solubilité dans l'eau :
| Chlorure de sodium | 360 g/L |
|---|---|
| Benzaldéhyde | 3,3 g/L |
| Acide Benzoïque | 2,4 g/L |
| Diiode | 0,34 g/L |
Les facteurs influant la solubilité
De nombreux facteurs peuvent influencer la solubilité d’une espèce chimique : ils peuvent augmenter ou diminuer la solubilité d’une espèce chimique. Parmi ces facteurs, on trouve...
La température
La solubilité d’une substance dans un solvant est fortement influencée par la température du solvant. En chauffant un liquide on n’accélère pas seulement le processus de dissolution mais on augmente la solubilité de la plupart des solutés.
Les autres solutés
La présence d’autres substances dissoutes est susceptible de limiter la solubilité d’un soluté en particulier lorsqu’on dissout un solide ionique dont l’un des ions est déjà en solution.
Le pH
Le pH peut modifier la solubilité de certains composés et en particulier ceux dont l’un des ions est un acide ou une base.
La pression
Si la pression augmente, généralement si le soluté est gazeux, sa solubilité augmente. La loi de Henry décrit très bien la solubilité des gaz dans l’eau.
La présence de liaisons hydrogènes
La présence de liaisons hydrogènes (voir cours sur les solides moléculaires) : les liaisons hydrogènes se forment entre un atome très électronégatif lié à un hydrogène et un autre atome électronégatif se trouvant à proximité. Ainsi la présence de liaisons hydrogène et plus généralement la présence d’une polarité influencent la solubilité.
L'extraction par solvant
Qu'est ce qu'une extraction ?
Une extraction est un procédé qui permet de retirer un ou des espèces chimiques présent dans un milieu liquide ou solide.
Quelles sont les principales méthodes d’extraction ?
- Décoction : la décoction se réalise généralement pour une plante. Pour réaliser une décoction, on prépare les parties végétales que l’on place dans de l’eau froide. On porte ensuite le mélange à ébullition puis on le refroidit et on le filtre.
- Macération : c'est une technique plus longue d'extraction qui consiste à laisser un solide dans un liquide (solvant organique) froid pour que les espèces chimiques soient extraites doucement.
- Infusion : il s’agit d’une technique de dissolution d’un végétal (par exemple) placé dans une eau bouillante qu’on laisse refroidir.

- La décantation : cette méthode permet de séparer des composés uniquement par séparation mécanique : on trouve deux types de décantation : la décantation entre deux liquides non miscibles et la décantation liquide – solide (cette dernière méthode est par exemple utilisée pour traiter les eaux usées).
- L’enfleurage : cette méthode permet de récupérer des composés aromatiques de plantes fragiles en les déposant sur des graisses «absorbantes».
- L’hydro-distillation : il s’agit d’une distillation d’une solution aqueuse contenant des composés organiques qui ne sont pas miscibles dans l’eau. Cette technique est très ancienne et permet de récupérer des composés odorants ou des huiles essentielles.
Le saviez-vous ? L'hydro-distillation ou entrainement à la vapeur est une technique très ancienne qui remonte à l'Antiquité. Pour obtenir des huiles essentielles on porte à ébullition un mélange d'eau et de plantes. Les cellules végétales éclatent et libèrent les molécules odorantes que l'on récupère dans la vapeur d'eau. La vapeur d'eau passe ensuite dans un système "réfrigérant" et on peut les récupérer dans un récipient adapté. Le récipient contenant une phase aqueuse et l'huile essentielle. On ajoute ensuite une solution de chlorure de sodium qui est un composé qui a la particularité d'augmenter la polarité de l'eau. Ainsi les deux phases sont complètement séparées et on peut récupérer aisément les huiles essentielles. L'hydro-distillation peut être réalisée dans un alambic. Ce dispositif peut aussi être utilisé pour fabriquer des médicaments mais aussi de l'eau de vie en distillant des jus de fruits fermentés. 
Extraction par un solvant
Il est possible d’exploiter la différence de solubilité d’une espèce chimique dans différents solvants pour l’extraire du mélange qui la contient. Définition : l’extraction par solvant consiste donc à faire passer par solubilisation la substance à extraire dans un solvant. Rappel : le solvant est un liquide dans lequel se déroule la réaction chimique. Il a la propriété de dissoudre certaines substances. Cette extraction est possible à deux conditions :
- Le solvant initial et le solvant d’extraction ne doivent pas être miscibles afin de pouvoir constituer deux phases distinctes et facilement séparables.
- L’espèce chimique à extraire doit être beaucoup plus soluble dans le solvant d’extraction que dans le solvant de départ.
Un exemple d'extraction : l'extraction du diiode
Pour réaliser l’extraction du diiode présent dans une solution aqueuse, il faut dans un premier temps choisir un solvant.
On peut utiliser le cyclohexane car il n’est pas miscible avec l’eau (il est totalement insoluble : quand on le place dans l’eau le diiode reste sous forme d’un solide blanc) car le diiode y est nettement plus soluble que dans l’eau.
Le diode possède une caractéristique intéressante : quand il se trouve en solution dans un solvant où il est miscible, il colore ce solvant : suivant le solvant le diiode peut donner différentes couleurs à la solution.
Le cyclohexane par exemple prend une teinte qui va du rosé au violet. Cela peut permettre de repérer facilement les deux phases.
Qu'est ce que le diode ?
Le diiode (I2) est une molécule composée de deux atomes d’iode.
En dissolvant du diiode dans un solvant type alcool on obtient de la teinture d’iode qui possède des propriétés antiseptiques notables.
En effet, le diiode est retrouvé dans la composition de la bétadine, célèbre antiseptique utilisé pour nettoyer les plaies. Le diiode est une molécule qui possède une solubilité importante dans les solvants type cyclohexane ou dichlorométhane en revanche sa solubilité est beaucoup plus faible dans les solvants comme l’eau.
Principe de l'extraction du diiode ?
Prenons une solution de diiode et de cyclohexane. La solution aqueuse comprenant du diiode et le cyclohexane est alors introduite dans une ampoule à décanter. Quand on verse le cyclohexane dans l’ampoule, celui-ci se place au dessus de la solution : en effet, le cyclohexane dont la densité de 0,78 est inférieure à l’eau constitue la phase supérieure. Le contenu de l’ampoule à décanter doit alors être agité afin de faciliter le contact entre les deux solvants et de faciliter le transfert du diiode dans le cyclohexane. Ensuite le contenu de l’ampoule est mis au repos pour que la décantation puisse avoir lieue. Le diiode passe dans le cyclohexane car il est beaucoup plus soluble dans ce solvant que dans l’eau. Une fois que tout le diiode est entièrement passé dans la phase supérieure (dans le cyclohexane) il ne reste plus qu’à récupérer les deux phases. On ouvre le robinet pour laisser passer la phase aqueuse (qui ne comprend pas de diiode) puis on peut récupérer le cyclohexane contenant le diiode. Attention, l’ampoule à décanter doit régulièrement être dégazée dans des conditions de sécurités optimales. En effet, dans une ampoule à décanter il peut arriver que des réactions chimiques se réalisent et des gaz peuvent se former où des solvants peuvent s’évaporer, le dégazage empêche tout risque de surpression (et d’éclatement). Il faut toujours dégazer loin des autres manipulateurs dans un endroit sécurité et ne pas diriger l’ampoule vers soi. Note : la solution de diiode initiale peut contenir des impuretés qui ont une plus forte solubilité dans l’eau que dans le cyclohexane, ces impuretés ne passeront pas dans le cyclohexane. 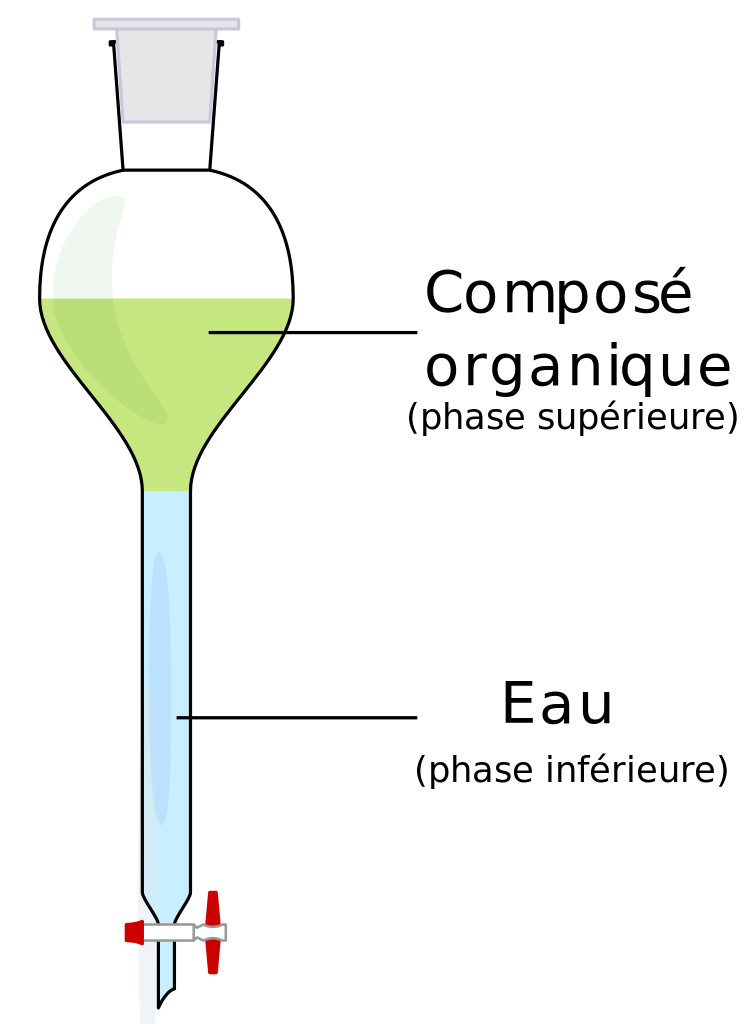























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Décrire en bref le protocol expérimental de cette extraction par solvant utilisé ? Pour lexpértion du l’éstrgon
Bnsr svpl quelle sont les meilleures condition pour avoir un meilleure extraction
Pourriez-vous m’aider s’il-vous-plaît ? Je dois trouver la dose de sucre dans du coca (sans regarder l’étiquette évidemment) et je ne sais pas comment m’y prendre.
Bonjour, j’ai une petite exploitation des champignons médicinaux en Normandie. Je cherche à faire des concentrés liquides et solides (extraits) à partir des champignons. J’ai beaucoup entendu parler de la dégradation des polyphenols par la temperature.
Je cherche quelqu’un qui puisse m’éclairer sur le sujet.
Cordialement
Bonjour j’ai fait un tp aujourd’hui ou on essayer de voir quel solvant d’extraction était le meilleur pour l’acide benzoïque, nous avons d’abord fait une extraction par décantation avec deux solvants d’extraction différents, nous avons fait ensuite un titrage avec chaque phase aqueuse des 2 essaie nous avons donc le volume équivalent et la concentration en Acide benzoïque et je ne comprends pas comment faire pour savoir qu’elle est le meilleur solvant ? Pourriez vous me l’expliquer s’il vous plaît. Merci d’avance
Bonjour
Et si les impuretés avaient une plus fortes dissolution dans le solvant que dans l’eau ? Cela reviendrait-il a dire qu’on a déplacé le problème ?
très intéressant l’article
je kiffe
La question c’est comment récupérer le diode pur après l’isolement de la phase organique . Peut-être par vaporisateur du cyclohexane