Chapitres
Le dosage par étalonnage est une méthode géniale en chimie pour mesurer la concentration d'une substance dans un échantillon.
👩🔬 On crée une courbe en utilisant des concentrations connues, puis on l'utilise pour estimer la concentration de la substance dans un échantillon inconnu
C'est comme résoudre un casse-tête scientifique !

Définition de la notion de dosage 🤏🏼

Un dosage est une technique qui permet de déterminer la concentration molaire d’une espèce chimique dissoute dans une solution. Il existe plusieurs méthodes pour doser une espèce en solution, on peut par exemple utiliser :
📊 Le dosage par titrage
🧪 Le dosage par étalonnage
C’est ce dernier type de dosage que nous allons développer.
Les techniques de dosages, qu'elles soient obtenues par titration ou étalonnage, sont très importantes dans de nombreuses industries :
💊 En médecine, pour doser les médicaments
🧃 Dans l'agro-alimentaire, pour doser les boissons
On utilise par exemple les techniques de dosage en médecine pour doser des médicaments ou encore dans l'industrie agro-alimentaire pour doser les quantités de solutés à incorporer dans les boissons (on peut étudier par exemple la concentration du fer dans le vin, on peut étudier la concentration de certains acides dans des boissons de type cola...).
Principe d'un dosage par étalonnage 🧪

Un dosage colorimétrique correspond à celui qui peut être effectué lorsqu'une réaction chimique produit un produit coloré et si l'intensité de la coloration est proportionnelle à la concentration de l'élément chimique à doser.
Par conséquent, la réaction est logiquement basée sur la loi de Beer-Lambert. Cette loi dit que plus une substance est concentrée et plus le milieu traversé est épais, plus elle absorbe de lumière.
⚠️ À noter que des dosages colorimétriques peuvent également être réalisés à l'aide d'un indicateur coloré qui se colorera en fonction des variations de pH, indiquant le point d'équivalence de la réaction
🌈 Dans ce cas, on parle de titrage colorimétrique
Pour effectuer une telle détermination, il est alors nécessaire de procéder à la conception de la gamme standard.
Explication du principe
Le dosage par étalonnage repose sur l’utilisation de solutions (appelées "solutions étalons") qui contiennent l’espèce chimique à doser en différentes concentrations connues.
Il suppose également que la concentration de l’espèce chimique influe sur une grandeur physique ( comme l'absorbance, la conductivité...) qu’il est possible de mesurer.
👉🏼 En effet, il faut utiliser des valeurs qui sont dépendantes de la concentration
On compare ensuite les propriétés physiques de l’échantillon à la même propriété physique pour une gamme étalon.
Le phénomène de dilution
La dilution correspond au processus d'obtention d'une solution finale avec une concentration inférieure à la solution de départ. Cela peut ensuite être fait en ajoutant du solvant ou en extrayant une partie de la solution puis en terminant jusqu'à ce que le solvant atteigne le volume souhaité.
La dilution peut alors être caractérisée par le taux de dilution. Pour cela, cependant, il faut supposer que le diluant est soluble dans le solvant utilisé.
Dilution par ajout de solvant
On note la concentration d'une solution C et il est possible de la calculer avec la formule suivante :  Avec :
Avec :
- C la concentration molaire. Cette unité s'exprime en mol.L-1 ;
- n la quantité de matière du soluté en solution. Cette unité s'exprime en mol ;
- Et V le volume de solvant. Cette unité s'exprime en L.
Ainsi, si on procède à une dilution par ajout de solvant, la solution initiale et la solution finale contiennent autant de quantité de soluté. Cela signifie alors que ninitiale = nfinale . On a alors les relations suivantes qui se dégagent : 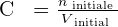
 On peut déduire de ces relations le rapport suivant :
On peut déduire de ces relations le rapport suivant : 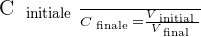
Il est possible d'exprimer le taux de dilution avec la relation suivante :
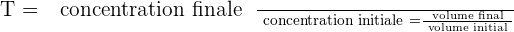
Il est important de savoir que le taux de dilution, noté T, est une grandeur sans unité et qui présente obligatoirement une valeur positive et inférieure à 1. Quant au taux de dilutions successives, il correspond au produit des taux de dilution de chaque dilution.
Créer une gamme étalon pour obtenir des résultats 🏆

Certains critères doivent être respectés pour effectuer un dosage colorimétrique :
- La réaction doit produire une teinte ou une opacité proportionnelle à la concentration
- La teinte ou l'opacité doit être constante pendant le processus de mesure
- Le composé à analyser doit être en concentration extrêmement faible (jamais dilué)
- Une gamme d'étalonnage doit être réalisée dans les mêmes circonstances physiques et chimiques que les expériences
- La longueur d'onde du spectrophotomètre doit être celle qui permet la plus grande absorption
Si l'ensemble de ces conditions sont remplies, il est possible d'obtenir un dosage colorimétrique.
Protocole à suivre
Il est nécessaire de faire une gamme d'étalonnage afin de calibrer le spectrophotomètre (y compris pour certains kits vendus dans le commerce). Cette gamme permet de déterminer l'absorbance à une longueur d'onde donnée, pour un certain tube ou une certaine cuve de spectrophotomètre, pour une concentration de composé donnée.
✅ Par conséquent, il faut préparer une solution de dosage de l'élément à faible concentration
Le volume ultime de liquide dans chaque tube doit être le même afin d'obtenir la gamme d'étalonnage et de dosage. Ou, pour que la réaction se produise, les volumes des réactifs doivent rester constants, mais les quantités (liées aux concentrations) de composé à doser doivent varier dans chaque tube. Dans certaines méthodes de dosage, on complète avec de l'eau distillée afin d'atteindre un même volume (par exemple 100 ml) en ajustant le niveau à une jauge caractéristique.
Pour éliminer l'absorption causée par les réactifs eux-mêmes, il faut construire un tube 0 ou blanc. Ce tube ne contient aucun composé de dosage.
La création d'une gamme d'étalonnage nécessite une grande précision (utilisation de fioles jaugées, de pipettes, etc.) et doit être réalisée dans les mêmes conditions et par le même opérateur tout au long des manipulations.
Créer un tableau colorimétrique
La création d'une table colorimétrique permet d'éviter les erreurs lors de l'exécution du protocole et de l'enregistrement des résultats.
Nous allons ici illustrer le protocole avec un exemple de table colorimétrique pour un dosage du phosphore.
| Tube | 0 | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|---|
| Quantité de phosphore (µmol) | 0 | 0,2 | 0,4 | 0,6 | 0,8 | 1 |
| Absorbance à 700 nm | 0 | 0,267 | 0,512 | 0,772 | 1,028 | 1,306 |
Lire les résultats de l'analyse

Après avoir obtenu les valeurs d'absorbance de la gamme d'étalonnage, on représente la courbe d'absorption en fonction de la quantité (ou, plus couramment, de la concentration) du composé. Si la gamme a été bien réalisée (coefficient de corrélation supérieur à 99,95 %, par exemple), une droite devrait passer par l'origine du graphique et être proche de chaque point d'étalonnage.
Pour déterminer la quantité de composé présent, rapportez la valeur d'absorbance de l'expérience (la solution initiale peut avoir été microfiltrée). Pour remonter à la concentration initiale du composé à analyser, tenir compte du volume de l'échantillon et d'une éventuelle dilution.
Pour réaliser un dosage par étalonnage, il faut reporter sur un graphique des points dont l’abscisse correspond à la concentration des solutions connues et l’ordonnée correspond à la grandeur physique mesurée.
📉 On obtient alors une courbe appelée courbe d’étalonnage. Il suffit alors de mesurer la grandeur physique de la solution à doser afin d’obtenir un point de la courbe dont l’abscisse indique la concentration recherchée
Le graphique ci-dessus représente une courbe d’étalonnage linéaire (ce qui est souvent le cas). Elle a été tracée en utilisant des solutions étalons de concentration C1, C2, C3, C4 et C5 associées respectivement à des grandeurs X1, X2, X3, X4 et X5. La solution dosée à une concentration C qui peut être trouvée en plaçant sur la courbe le point d’ordonnée X (grandeur mesurée pour la solution dosée ).
En effet, selon les lois de chimie, la matière se conserve, ainsi :
CiVi = CfVf.
Avantages et limites d'un dosage par étalonnage 👍/👎
Avantages
1️⃣ Le dosage par étalonnage est une technique non destructive puisqu’elle n’altère par l’échantillon dosé contrairement aux dosages par titrage qui nécessitent une réaction chimique
2️⃣ Par ailleurs, il n’exige en règle générale qu’un volume modéré de solution
Inconvénients
1️⃣ Quand on réalise un dosage par étalonnage par conductimétrie, cela impose de connaître la nature des ions présents en solution (ce qui n’est pas toujours facile à réaliser)
2️⃣ Quand on réalise un dosage d’étalonnage par spectrophotométrie, il faut que la lumière soit monochromatique et que la concentration ne soit pas trop élevée
Principales techniques de dosage par étalonnage 🥼
Les principales techniques utilisées pour réaliser un dosage par étalonnage sont la spectrophotométrie et la conductimétrie.
La spectrophotométrie

Définition
Quand la lumière passe à travers une solution colorée, celle-ci est absorbée par le ou les solutés. On parle d’absorbance ou encore de densité optique.
La spectrophotométrie permet ainsi d’étudier d’absorbance de solutions dans l’infrarouge, le visible et dans l’ultraviolet. En effet, quand la lumière blanche (qui est composée de toutes les couleurs) passe à travers une solution colorée, la solution n’absorbe que quelques radiations et les autres sont ré-émises.
Mesurer l'absorbance
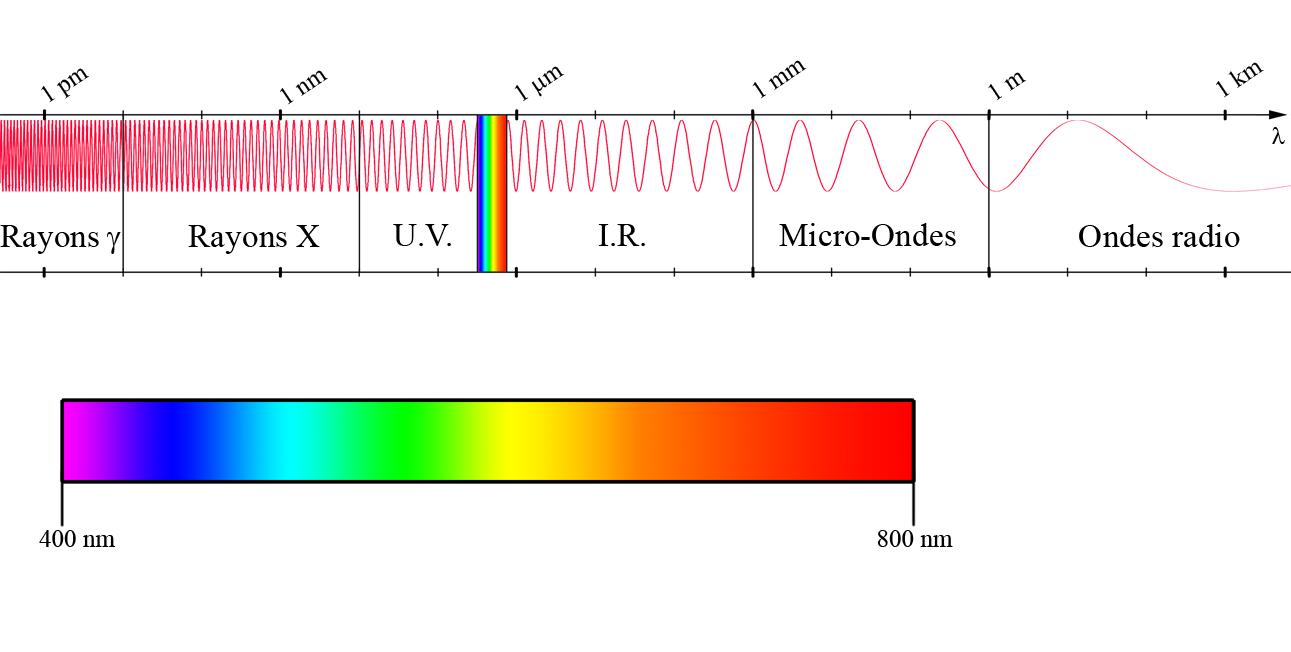
On mesure l’absorbance (A) grâce à un spectrophotomètre.
📏 Celui-ci mesure qui l’absorbance (A) d’une solution pour une longueur d’onde donnée
Le spectrophotomètre est composé d’une source de lumière et d’une fente qui permet d’isoler un faisceau quasi monochromatique (pour ne sélectionner qu’une seule longueur d’onde). Dans une cuve, on introduit la solution à tester.
Un détecteur placé après la cuve permet de détecter les intensités lumineuses avant et après le passage du faisceau.
Évolution de l'absorbance
Elle varie en fonction de la concentration en suivant la loi de Beer-Lambert:
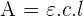
Avec ε = absorbance appelée aussi coefficient d’extinction spécifique, l = longueur de la cuve, c la concentration en solution
Cette formule indique une relation linéaire entre l’absorbance et la concentration ce qui implique que la courbe d’étalonnage est une droite et peut donc être tracée avec un nombre limité de points.
Protocole
Avant toute chose, on étalonne le spectrophotomètre en utilisant une solution de solvant pour régler le « zéro ». (Cette solution s’appelle un blanc).
On utilise une solution mère colorée (par exemple de la teinture d’iode). On effectue ensuite une série de dilution et on note l’absorbance indiquée pour chaque solution fille.
Mise en application
Le tableau suivant donne les résultats d’une absorbance de diverses solutions étalons :
| Numéro d'échantillon | Concentration en mg/l | Absorbance |
|---|---|---|
| 1 | 5 | 0.388 |
| 2 | 10 | 0.775 |
| 3 | 15 | 1.17 |
| 4 | x | 0.590 |
Comment peut-on trouver la valeur de la concentration pour l'échantillon numéro 4 ?
Il suffit de tracer le graphique A = f(C). Le graphique va donner une droite, il suffit de repérer l’absorbance 0.590 et de reporter la mesure sur la droite. La concentration recherchée est de 7,5 mg/L.
La conductimétrie

Définition
Quand une solution contient des ions, elle conduit l’électricité. Dans le cas contraire, on dirait que la solution est isolante. Une solution ionique, appelée électrolyte, est conductrice d’électricité à cause de la présence d’ions.
Ainsi (contrairement à ce qui peut se faire en physique ou on étudie la résistance), on étudie la conductance de certaines solutions car elle est proportionnelle à la concentration en soluté.
✅ Bon à savoir
Dans une solution ionique, on trouve des ions chargés positivement que l’on nomme cations et des ions chargés négativement que l’on nomme anions.
⚠️ Attention à ne pas confondre :
- Les anions et les cations ❌ les électrodes de sortie, en physique, appelées cathodes et anodes
Pour rappel :
✅ La cathode est chargée positivement
🚫 L'anode est chargée négativement
Mesure de la conductance
La conductance ou conductivité est mesurée à l’aide d’un conductimètre. Le conductimètre est un capteur qui permet de mesurer la conductivité d’une solution entre deux électrodes.
Noter la conductimétrie
La conductivité d’une solution est notée σ et s’exprime en Siemens par mètre.
La conductivité d’une solution est l’inverse de la résistance, on peut donc la noter ainsi :
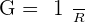
Avec R = La résistance en Ohm.
On peut aussi en déduire sachant que U = R.I que la conductivité peut s’écrire ainsi :
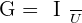
La conductance est surtout fonction de la surface des électrodes, de la distance entre elles.

Où S est la surface des électrodes et L la distance entre elles et σ la conductivité de la solution.
Généralement, on simplifie la relation ainsi : 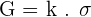
où k représente la constante de la cellule.
La conductivité d’une solution dépend essentiellement de trois paramètres :
- La température
- La nature des ions
- La concentration
👉🏼 La loi de Kohlraush établit la relation entre la concentration d’une solution et la conductivité
Ainsi pour une solution diluée, la conductivité d’un électrolyte σ est proportionnelle à sa concentration : 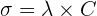 Il s’agit d’une relation linéaire qui aboutit à une courbe d’étalonnage correspondant à une droite.
Il s’agit d’une relation linéaire qui aboutit à une courbe d’étalonnage correspondant à une droite.
Mise en œuvre
Il faut se munir d’une pipette graduée contenant un réactif titrant. On place la pipette au-dessus d’un bécher muni d’un agitateur magnétique et on plonge le conductimètre.
✅ Bon à savoir
Les mesures de conductance se font toujours sous agitation magnétique. La cellule du conductimètre ne doit jamais toucher les parois du bécher. On verse progressivement (goutte à goutte) le réactif dans le bécher et on note les volumes versés et la conductance observée et on reporte les données sur un graphique (sur papier millimétré idéalement).
🧫 Pour effectuer l’étalonnage, on utilise une solution dite étalon dont on connaît la conductance à la même température
Bon à savoir : dans les exercices de chimie sur les titrations par étalonnage, on demande à l'élève d'être très rigoureux dans le tracé des courbes. Faites bien attention a reporter les mesures, si possible sur un papier adapté comme un papier millimétré (lors d'examens ces papiers sont fournis). Une erreur de report peut fausser votre réponse.
Et vous voilà incollable sur le sujet !























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Je voudrais poser une question
Très édifiant , merci beaucoup , j’aime un bon prof pour approfondir cet item avec des exercices types
Merci bcp c’est très généreux
j’ai une question svp
comment fair le dosage spechtrométrique par un réctif en details la gamme et le blanc utilisé et les cas possible lorsque la solution plus foncé que le réactif et l’inverse ?
Le sodium présent dans 5 cm 3 de sang d’un patient est extrait par un traitement physico-chimique convenable. L’extrait recueilli est dilué au 1/10 avec de l’eau distillée. On le dose par HPLC, la surface du pic qui nous intéresse est de 65 (Ua : Unité arbitraire).
Par ailleurs, on prépare une solution étalon mère à 0,2 M en NaCl puis une solution fille par dilution au 1/10 de la solution mère. Ces solutions sont ensuite préparées par dilution de la solution étalon fille et leurs injections par HPLC, faites dans les mêmes conditions que l’essai dont l’ensemble des mesures sont consignées dans le tableau ci-dessous :
Solution A B C D
Volume de la solution fille en cm3 5 10 20 40
Volume d’eau distillée ajouté 95 90 80 60
Surface(Ua) 6 2 125 250 500
1-Déduire la droite d’étalonnage A=F(C), où C est la concentration de Na en mol/l.
2-Déterminer la concentration de Na dans le sang ainsi que le nombre de mol de Na se trouvant dans la prise d’essai de 5 cm 3 de sang.
3-Dites si ce taux est normal sachant que les normes sont 200-250 mg /5ml.
Bonjour,
Nous ne faisons pas leurs devoirs à la place des élèves, mais si vous avez besoin d’une aide personnalisée, vous pouvez contacter l’un de nos professeurs 🙂
Bonjour, tout d’abord merci pour vos cours qui me sont d’une grande aide !
Cette année on a de nouveaux programmes, avez vous donc fais un cours sur les dosages ph-métriques ?
Merciii beaucoup