Chapitres

Définition de la durée d'une réaction chimique
Une réaction chimique correspond, par définition, à la transformation d'espèces chimiques appelées les "réactifs " en de nouvelles espèces chimiques appelées les "produits".
Cette transformation ne peut avoir lieu que lorsque les particules (ions ou molécules) qui composent les réactifs rentrent en contact les unes avec les autres. Par conséquent, une réaction chimique n'est jamais réellement instantanée puisqu'elle nécessite le mouvement et la rencontre des particules de réactifs. La durée d'une réaction correspond donc au temps qui s'écoule entre l'instant initial où les réactifs sont mis en présence et l'instant final où la composition chimique du milieu a cessé d'évoluer. Remarque : quand la réaction est terminée, l'avancement (x) de la réaction prend alors sa valeur finale xfinal qui correspond aussi à sa valeur maximale.
Les réactions chimiques lentes et rapides
Les réactions chimiques lentes
Une réaction chimique est considérée comme lente lorsqu'il faut un certain temps pour observer à l'œil nu ou grâce à des appareils de mesure une évolution du système chimique. La formation des produits se réalise donc à une échelle de temps qui va de quelques secondes à plusieurs heures voire plusieurs jours ou mois. Remarque : lorsque la durée commence à se compter en jours, on parle alors de réactions infiniment lentes ou encore extrêmement lentes. Quelques exemples de réactions lentes :
- les réactions d'estérification
- les réactions d'hydrolyse
- certaines réactions d'oxydo-réduction (comme la corrosion)

Un exemple de réaction lente bien connue est la dissolution dans l'eau de médicaments. La formation de rouille est quant à elle une réaction extrêmement lente.

Les réactions chimiques rapides
A l'inverse d'une réaction lente, on considère qu'une réaction chimique est rapide si la formation des produits est perçue de manière instantanée par les sens humains dès que les réactifs sont mis en contact les uns avec les autres. La réaction est alors trop courte pour que son évolution puisse être suivie à l'oeil nu ou à l'aide d'appareils de mesure. Cela signifie donc qu'elle se déroule à une échelle de temps qui est inférieure à la seconde. Quelques exemples de réactions rapides :
- les réactions de précipitation
- les réactions acido-basiques
- les réactions de combustion explosives
- certaines réactions d'oxydo-réduction.
Un exemple de réaction rapide connue est la réaction de précipitation. Prenons par exemple le cas de la soude (NaOH) dans une solution de Sulfate de Cuivre (CuSO4).
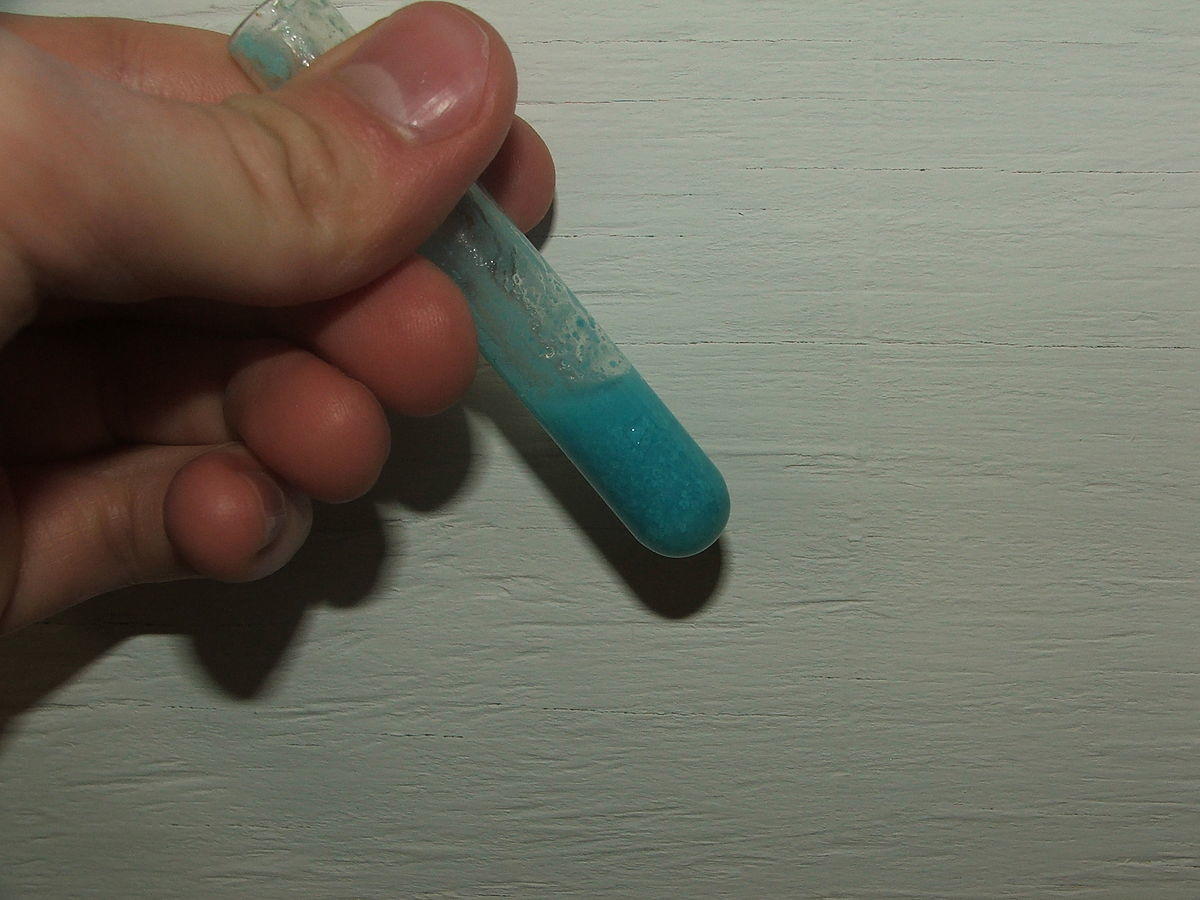
Le mélange des réactifs conduit instantanément à la formation d'un précipité d'hydroxyde de Cuivre (Cu(OH)2) suivant l'équation de réaction suivante :
Cu 2+ + 2 OH – → Cu(OH) 2
Suivi dans le temps d'une réaction chimique
Qu'est-ce que la cinétique ?
La cinétique chimique consiste à étudier l'évolution d'une réaction chimique dans le temps. Afin de faire le suivi de cette évolution dans le temps, on s'intéressera par exemple à la modification des concentrations des réactifs ou des concentrations des produits au fur et à mesure de l'avancement de la réaction.
Comment effectuer le suivi d'une réaction chimique dans le temps ?
L'objectif est ici de connaître l'évolution du système chimique à chaque instant de la réaction. Pour faire ce suivi, il est possible de tracer la courbe d'évolution des concentrations des espèces chimiques en présence dans ce système chimique :
- La courbe d'évolution de la concentration d'un réactif sera décroissante puisque la concentration de ce réactif diminue au fur et à mesure de l'avancement de la réaction
- La courbe d'évolution de la concentration d'un produit sera quant à elle croissante puisque la concentration de ce produit augmente au fur et à mesure de l'avancement de la réaction
Afin de tracer ces courbes, on aura recours à des appareils de mesure tels qu'un conductimètre en mesurant la conductivité ou encore un spectrophotomètre en mesurant l'absorbance.
Durée de réaction et temps de demi-réaction
Qu'est-ce que la durée de réaction ?
La durée d'une réaction chimique correspond au temps tfinal nécessaire pour que le réactif limitant soit entièrement consommé.
A cet instant tfinal, l'avancement de la réaction noté x est maximal : x = xfinal
Qu'est-ce que le temps de demi-réaction ?
Lorsqu'une réaction évolue assez lentement, il n'est pas évident de savoir quand elle se termine. Le temps de demi-réaction permet alors de caractériser l'évolution du système. Ainsi, le temps de demi-réaction correspond au temps qui s'écoule entre le début d'une réaction (t = 0) et l'instant (noté t1/2) où l'avancement a une valeur égale à la moitié de l'avancement final (xfinal) : A t = t1/2 
Le temps de demi réaction permet donc de se faire une idée de la durée d'une réaction chimique. Suivant la précision choisie, on considère que la réaction est terminée lorsque le temps qui s'est écoulé depuis le début de la réaction est équivalent à cinq à dix fois la valeur du temps de demi réaction. Attention : à cause de son nom, il est fréquent de penser que la durée de la réaction est égale au double du temps de demi réaction. Cependant, c'est une erreur car la vitesse à laquelle une réaction chimique se réalise n'est pas constante et a d'ailleurs tendance à baisser lorsque la concentration des réactifs diminue.
Détermination du temps de demi-réaction
Le temps de demi réaction peut être déterminé à partir de la courbe qui représente les variations de l'avancement (x) en fonction du temps (t). En effet, il suffit de :
- Déterminer sur cette courbe la valeur de l'avancement final (xfinal)
- Diviser par deux l'avancement final (xfinal)
- Se placer sur l'ordonnée qui correspond à la moitié de l'avancement final
- Déterminer l'abscisse qui correspond à cette ordonnée : elle est égale au temps de demi-réaction
Reprenons ces étapes en faisant l'exercice sur les graphiques se trouvant ci-dessous :
| Etape 1: déterminer la valeur de l'avancement final de la réaction (xfinal) |
 |
| Etape 2 : diviser par deux l'avancement final (xfinal) Etape 3 : se placer sur l'ordonnée qui correspond à la moitié de l'avancement final |
 |
| Etape 4 : déterminer l'abscisse qui correspond à cette ordonnée : elle est égale au temps de demi-réaction |
 |























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Et la durée de la réaction total ? A partir de t1/2
Bonjour ! Pour aller plus loin, n’hésitez pas de solliciter nos professeurs particuliers sur Superprof pour une aide personnalisée et plus poussée. Bonne journée ! 🙂
J’aimerais si lorsque une réaction chimique se termine en 10 est-ce que le temps de demi-vie peut est être égale ou inférieure à 5 min
Bonjour,
J’effectue des recherches autour de l’acidité métabolique provoquée par la contraction musculaire intense lors d’efforts.
.
J’aurai besoin d’avoir une idée de la totalité des réactions chimiques de la glycolyse anaérobie avec substrat glycogène.
.
Donc, les durées :
– de la glycogénolyse;
– les 9 autres réactions de la glycolyse;
– la LDH (lactate déshydrogénase);
– et l’hydrolyse de l’ATP.
Est-ce possible ?
Si oui, je suis même preneur des durées approximatives.
Elles peuvent même être relatives les unes par rapport aux autres.
.
Merci d’avance.
Bonjour ! Ces durées sont bien trop floues pour pouvoir vous les donner. Car typiquement, la glycolyse, vous le savez, se découpe en 10 réactions, elle-mêmes découpées en trois phases. Autant de phases qui rendent les contours de la réponse bien trop flous.
Pour quelle raison en aviez-vous besoin ?
Bonne journée !
Pour quoi en utilisé t1/2
Et non t1/4
Pour définir la reaction