Chapitres
- 01. Introduction des objectifs de la chimie
- 02. Modifications réalisables sur une molécule organique
- 03. Les principales catégories de réactions chimiques
- 04. Les groupements réactifs
- 05. La synthèse organique au laboratoire
- 06. Synthèse asymétrique
- 07. Les réactions chimiques spontanées
- 08. Règle de sécurité en synthèse organique
- 09. Exemples de réactions chimiques
- 10. Les transformations via les réactions d'oxydoréduction
- 11. Les transformations via les réactions acido-basiques

Introduction des objectifs de la chimie
La chimie est une science de la nature, science de la matière et de sa transformation. Les différents états de la matière et les différents types de transformation de la matière ont déjà été en partie étudiés dans le parcours antérieur de l’élève, au collège et au lycée. Il s’agit de réactiver et de compléter ces connaissances déjà acquises, afin d’amener les élèves à les mobiliser de manière autonome pour décrire, au niveau macroscopique, un système physico-chimique et son évolution.
Dans ce cadre, l’étude quantitative de l’état final d’un système en transformation chimique est réalisée à partir d’une seule réaction chimique symbolisée par une équation de réaction à laquelle est associée une constante thermodynamique d’équilibre. L’objectif visé est la prévision du sens d’évolution de systèmes homogènes ou hétérogènes et la détermination de leur composition dans l’état final ; on s’appuiera sur des exemples variés de transformations chimiques rencontrées dans la vie courante, au laboratoire, dans le monde du vivant ou en milieu industriel. Les compétences relatives à cette partie du programme seront ensuite mobilisées régulièrement au cours de l’année, plus particulièrement au second semestre lors des transformations en solution aqueuse, et en seconde année, notamment dans le cadre de la partie thermodynamique chimique.
Dans un souci de continuité de formation, les acquis du lycée concernant les réactions acido-basiques et d’oxydo-réduction, la conductimétrie, la pH-métrie et les spectroscopies sont réinvestis lors des démarches expérimentales. L’importance du facteur temporel dans la description de l’évolution d’un système chimique apparaît dans l’observation du monde qui nous entoure et a déjà fait l’objet d’une première approche expérimentale en classe de Terminale, permettant de dégager les différents facteurs cinétiques que sont les concentrations, la présence ou non d’un catalyseur et la température.
La prise de conscience de la nécessité de modéliser cette évolution temporelle des systèmes chimiques est naturelle. Si la réaction chimique admet un ordre, le suivi temporel de la transformation chimique doit permettre l’établissement de sa loi de vitesse. Cette détermination fait appel à la méthode différentielle voire à la méthode intégrale, pour l’exploitation de mesures expérimentales d’absorbance ou de conductivité du milieu réactionnel par exemple, dans le cadre d’un réacteur fermé parfaitement agité. Les équations différentielles étant abordées pour la première fois en PCSI, il est recommandé de travailler en étroite collaboration avec le professeur de mathématiques et d’avoir en chimie des exigences progressives dans la maîtrise de cet outil.
La modélisation au niveau microscopique d’une transformation chimique par un mécanisme réactionnel complète l’étude cinétique macroscopique de la réaction chimique et permet d’aborder la notion de catalyse ; des exemples de catalyses homogènes, hétérogènes et enzymatiques seront rencontrés tout au long de la formation.
Une ouverture à la cinétique en réacteur ouvert, dans un cadre très limité, permet en complément d’appréhender la différence d’approche à l’échelle industrielle et de montrer l’utilité d’un tel dispositif pour la détermination expérimentale de la loi de vitesse.
À travers les contenus et les capacités exigibles, sont développées des compétences qui pourront être, par la suite, valorisées, consolidées ou réinvesties, parmi lesquelles :
- Faire preuve de rigueur dans la description d’un système physico-chimique ;
- Distinguer modélisation d’une transformation (écriture de l’équation de réaction) et description quantitative de l’évolution d’un système prenant en compte les conditions expérimentales choisies pour réaliser la transformation ;
- Exploiter les outils de description des systèmes chimiques pour modéliser leur évolution temporelle ;
- Proposer des approximations simplifiant l’exploitation quantitative de données expérimentales et en vérifier la pertinence ;
- Confronter un modèle mathématique avec des mesures expérimentales.
Modifications réalisables sur une molécule organique
La chimie organique constitue l'étude des transformations des molécules organiques (c'est-à-dire contenant un squelette carboné).
Ces transformations sont multiples : on distingue en général les transformations destinées à modifier la chaîne carbonée d'une molécule et celles qui permettent de modifier ses groupements chimiques.
Il est possible de modifier une chaîne carbonée des manières suivantes :
- En la raccourcissant : la molécule est séparée en plusieurs fragments.
- En l'allongeant : la chaîne carbonée d'une autre molécule lui est lié.
- En la ramifiant : des molécules se lient aux atomes de carbone situés à l'intérieur de la chaîne.
- En modifiant le nombre de double liaisons.

Il est également possible d'agir sur les groupements chimiques :
- En ajoutant de nouveaux groupements chimiques.
- En éliminant certains groupements chimiques.
- En modifiant des groupements chimiques.
Les principales catégories de réactions chimiques
Les différentes modifications décrites peuvent être réalisées en faisant appel à l'une des trois sortes de réactions suivantes :
- La substitution : un atome ou un groupe d'atomes d'une molécule est remplacé par un autre atome ou groupe d'atomes.
- L'addition : la double liaison entre deux atomes de carbone est remplacée par deux liaisons simples qui lient chacun de ces carbones à un nouveau atome ou groupe d'atomes.
- L'élimination : deux atomes de carbone voisins rompent une liaison simple qui les lie à un atome ou groupe d'atomes afin d'établir une double liaison entre eux.
Les groupements réactifs
Les molécules chimiques n'ont pas toutes la même réactivité. La taille de la molécules ainsi que les groupements fonctionnels qui la constitue (alcool, acides carboxylique, amine) sont des paramètres importants.
En effet une grosse molécule, très ramifiée, aura une accessibilité à certains centres réactifs difficile, on appelle cela l'encombrement stérique. Par contre, une molécule de petite taille aura tendance à être plus réactive. Enfin, les longues molécules pourront posséder plusieurs sites actifs peu encombrés.
Voici quelques exemples de groupements réactifs :
| Nom du groupement réactif | Alcool | Acides carboxylique | Anhydride | Cétones/aldéhyde | Ester |
|---|---|---|---|---|---|
| Formule semi-développée | 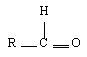 | ||||
| Nom du groupement réactif | Amine | Amide | Doubles liaisons | Ether | thiol |
| Formule semi-développée |  |
Une même molécule peut contenir plusieurs sites réactifs, dans ce cas la réaction se fera préférentiellement avec le site ayant une réactivité plus importante. Il existe cependant des techniques pour diriger la réaction vers le groupement voulu.
La synthèse organique au laboratoire
La synthèse organique se déroule en minimum 4 étapes :
- réaction chimique pour obtenir le produit voulu
- l'extraction du produit de son milieu réactionnel (solvant, sous-produits...)
- la purification du produit obtenu
- l'analyse, permettant de vérifier l'identité du produit obtenu et sa pureté
Dans certains cas de synthèse sur des réactifs contenant plusieurs fonctions réactives, il peut être nécessaire de protéger un groupement afin qu'il ne réagissent pas. Pour ce faire il faut rajouter deux étapes :
- ajout du groupement protecteur : protection
- élimination du groupement protecteur : déprotection
La protection se fait en amont de la réaction chimique, et la déprotection une fois le composé voulu obtenu, avant l'extraction.
La réaction chimique
La plupart des réactions chimiques ont lieu en milieu liquide dans un solvant approprié. Le milieu est souvent acide ou basique afin de faciliter la réactivité des molécules.
Dans certains cas, un catalyseur permettant d'accélérer la réaction (certaine réactions sont tellement lentes que l'on a l'impression qu'elle n'ont pas lieu) est ajouté. Le milieu peu également être chauffé afin d'accélérer la réaction mais aussi d'en améliorer le rendement.
Le montage de verrerie le plus courant en synthèse organique est le suivant :
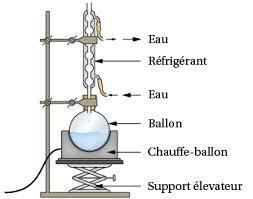
Le réfrigérant sert à recondenser les vapeurs entraînées par le chauffage, afin de ne pas perdre de produit par évaporation.
Si la réaction est fortement exothermique (dégage beaucoup de chaleur) il n'est pas nécessaire d'utiliser un chauffe ballon. Cela pourrait même provoquer un emballement dangereux de la réaction. Il est également possible de placer le ballon dans un bain de glace afin de contrôler le dégagement de chaleur.
L'extraction
Une fois la réaction chimique réalisée, il faut extraire le composé final du milieu réactionnel. En effet, ce dernier ne contient pas seulement le solvant et le produit, mais également des restes des réactifs initiaux (la réaction n'est pas nécessairement totale), de catalyseur, d'acide ou base selon les conditions initiales.
Des produits de réaction non désirés que l'on appelle sous-produits ou produits secondaires peuvent également coexister. En effet, les réactifs ont souvent plusieurs sites réactionnels et s'il existe une réaction privilégiée, d'autres en plus faibles quantités peuvent coexister.
Si la réaction a eu lieu à chaud, le milieu est d'abord refroidi. Ensuite, la méthode choisie dépend des propriété physico-chimique du produit obtenu. Si celui est liquide à température ambiante :
- Extraction liquide/liquide : le produit est plus soluble dans un autre solvant que celui choisi pour la réaction, et a une meilleure solubilité que les autres composants du milieu réactionnel dans ce solvant. Cette étape s'effectue dans une ampoule à décanter, et les deux solvants doivent être non miscibles. Ainsi l'on retrouvera le produit dans la phase supérieure ou inférieure selon les densités respectives des solvants.
- Cette extraction peut être suivie par une étape de séchage, c'est à dire, élimination du solvant :
- par évaporation (utilisation d'un évaporateur rotatif à basse pression)
- lyophilisation (possible si le solvant est de l'eau)
Si le produit est solide à température ambiante :
- filtration : à pression réduite, afin d'accélérer le passage du liquide au travers du filtre. Le solide récupéré est pâteux et doit être séché afin d'obtenir un poudre.
- Séchage :
- Au dessiccateur si le solvant est de l'eau. Il contient un solide hygroscopique qui capte l'eau résiduelle dans le solide.
- A l'étuve
La purification
Il est ensuite nécessaire de purifier le mélange obtenu. Il existe plusieurs manières, également dépendante des propriétés physico-chimiques de la molécule obtenues :
- Distillation fractionnée : elle est utilisée si le produit et les impuretés sont liquides à température ambiante et si leurs points d’ébullition sont différents. Le produit doit avoir la température d’ébullition la plus basse. Le milieu est chauffé doucement jusqu'à atteindre la température d'ébullition du produit. A cette température, seul le produit s'évapore et peut être récupéré après recondensation.
- Recristallisation : elle est utilisée si le produit et les impuretés sont solides à température ambiante. Le solide obtenu est dissout dans un solvant à chaud dans lequel les impuretés sont solubles à froid mais pas le produit. Le produit est récupéré par filtration puis séché. Les impuretés restes prisonnière du solvant.
La poudre ou le liquide obtenus peuvent alors être analysés.
Étapes optionnelles de protection/déprotection
Afin d'éviter qu'un groupement fonctionnel de la molécule ne réagisse avec l'un des réactifs de départ, une réaction de protection est effectuée spécifiquement sur ce site de la molécule. Il s'agit généralement d'une modification du groupement fonctionnel, le rendant ainsi moins réactif.
Cette modification doit facilement réversible afin de retrouver le groupement de départ ensuite.
Il est alors possible d'effectuer la réaction voulue sur l'autre site réactif devenu le groupement qui réagira le plus facilement sur cette nouvelle molécule.
Une fois l'intermédiaire de synthèse obtenu, on peut déprotéger le premier site réactif, par élimination du groupement protecteur, pour obtenir la molécule finale. Les étapes d'extraction, et de purification peuvent avoir lieu.
Synthèse asymétrique
En synthèse classique, si la molécule recherchée est chirale, un mélange racémique (50/50 des deux stéréoisomeres) est obtenu. Ceci est problématique dans l'industrie pharmaceutique, car seulement un seul des stéréo-isomères possède la bio-réactivité voulue.
Les deux stéréo-isomères ayant les même propriétés physico-chimiques (à l'exception de la déviation de la lumière polarisée) il est extrêmement difficile des les séparer post-synthèse, du moins en quantité et en temps raisonnable. De plus le rendement final est de fait abaissé d'au moins 50 %.
On préfère alors souvent effectuer ce que l'on appelle une synthèse asymétrique (ou stéréo-sélective), c'est à dire que seul le stéréo-isomère voulu est synthétisé. Pour ce faire, il faut utiliser des composés chiraux lors de la synthèse.
Les réactions chimiques spontanées
Peu de réactions organiques sont spontanées ou alors à une vitesse si lente qu'elles donnent l'impression de ne pas avoir lieu.
Cependant de nombreuses dégradations moléculaires liées à l'oxygène contenue dans l'air se produise naturellement (oxydation). C'est le cas du rancissement du beurre ou de l'huile. Ce phénomène ce produit d'autant plus que le corps gras est exposé à l'air, la lumière et la chaleur.
Au contact de l'oxygène de l'air, les doubles liaisons des acides gras (triglycérides) constituant le corps gras ont tendances à s'oxyder :
- la molécule contenant la double liaison carbone-carbone est découpée en plusieurs molécules oxygénées ou non (alcool, cétone, alcool, chaine carboné)
- les qualités organoleptiques du corps gras s'en trouvent modifiées (odeur, goût)
- On observe également un changement de couleur : pour le beurre, par exemple, la partie rance est plus sombre.
Ce qu'on appelle transfert thermique en sciences est plus couramment appelé chaleur dans la vie quotidienne. Un transfert thermique correspond à l'un des modes d'échange d'énergie thermique entre deux systèmes. Dans le cas du double vitrage, on parlera du système extérieur et du système intérieur (la maison). Cela correspond à une notion fondamentale de la thermodynamique et, contrairement au travail, les transferts thermiques correspondent à un bilan de transferts d'énergie dits microscopiques et désordonnées.
Il est possible de distinguer trois type de transfert thermique, tous pouvant coexister :
- La conduction correspond à la diffusion progressive de l'agitation thermique dans la matière ;
- La convection correspond au transfert thermique qui accompagne des déplacements macroscopiques de la matières ;
- Et le rayonnement qui correspond à la propagation de photons.
Ainsi, la quantité de chaleur, notée Q et exprimée en joule, correspond à la quantité d'énergie qui sera échangée par le moyen de ces trois différents type de transfert. Une convention indique alors que, lorsque Q > 0, on dit que le système reçoit de l'énergie. De plus, il peut être intéressant de retenir que la thermodynamique fait appel au concept de chaleur afin de mettre en place le premier mais aussi de deuxième principe de la thermodynamique.
Malgré tout cela, il reste de nombreuses ambiguïtés mais également de nombreuses confusions qui s'entretiennent. En effet, malgré le sens que l'on accorde à chaleur dans la vie quotidienne, le principe de chaleur au sens thermodynamique du mot n'a aucun lien avec la température. Cependant, il reste vrai que les transferts thermiques spontanées se font toujours du système le plus élevé en température vers le système le moins élevé en température même s'il reste possible de provoquer l'inverse grâce à une machine thermique comme un réfrigérateur.
Il est d'ailleurs intéressant de noter que, lorsqu'il y a un changement d'état, le corps pur ne changera pas de température bien qu'il échange de l'énergie sous forme de chaleur.
Les principes de la thermodynamiques
Il est important de noter que le premier et le deuxième principe de la thermodynamique sont les plus importants, mais il peut tout de même intéressant de connaître les deux autres.
Le principe zéro de la thermodynamique
Ce principe concerne la notion d'équilibre thermique. Ainsi, il est à la base de la thermométrie et s'énonce ainsi : si deux systèmes sont en équilibre thermique avec un troisième, alors ils sont aussi ensemble en équilibre thermique.
Le premier principe de la thermodynamique
Egalement appelé principe de la conservation de l'énergie, ce principe affirme que l'énergie est toujours conservée. Formulé autrement, cela signifie que l'énergie totale d'un système isolé reste constante. Ainsi, les événements qui se produisent au sein du système isolé ne se traduisent donc que par des transformations de certaines formes d'énergie en d'autres formes d'énergie. Puisque l'énergie ne peut pas être produite en partant de rien, elle est présente en quantité invariable dans la nature. Elle ne peut donc que se transmettre d'un système à un autre : on ne crée par l'énergie, on la transforme.
Ce principe est également considéré comme étant une loi générale pour toutes les théories physiques, notamment en mécanique, électromagnétisme ou physique nucléaire puisqu'on ne lui a jamais trouvé la moindre exception même si des doutes peuvent subsister lorsque l'on étudie les désintégration radioactives.
De puis le théorème de Noether, on sait que la conservation de l'énergie est intimement reliée à une uniformité de structure de l'espace-temps.
Le premier principe de la thermodynamique rejoint alors le célèbre principe popularisé par Lavoisier : "Rien ne se perd, rien ne se crée, tout se transforme."
Le deuxième principe de la thermodynamique
Egalement appelé principe d'évolution des système, ce principe affirme la dégradation de l'énergie. En effet, l'énergie d'un système passe de façon nécessaire et spontanée de formes concentrées et potentielles à des formes diffuses et cinétiques telles que le frottement ou la chaleur.
Ce principe introduit donc également la notion d'irréversibilité d'une transformation et la notion d'entropie. En effet, d'après le deuxième principe de la thermodynamique, l'entropie d'un système isolé augmente ou reste constante. Souvent interprété comme une mesure du désordre et comme l'impossibilité du passage du désordre à l'ordre sans intervention extérieur.
L'interprétation de ce principe se base sur la théorie de l'information de Claude Shannon et la mesure de cette information, également appelée entropie de Shannon.
La principale différence de ce principe avec le premier principe de la thermodynamique est l'origine statique de ce deuxième principe. En effet, les lois microscopiques qui gouvernent la matière ne le contiennent qu'implicitement et de manière statique. Cependant, le deuxième principe de la thermodynamique reste relativement indépendant des caractéristique des lois précédemment citée puisqu'il apparaît même si l'on suppose des lois simplistes à petite échelle.
Le troisième principe de la thermodynamique
Ce principe, quant à lui, est associé à la descente vers un état quantique fondamental d'un système dont la température s'approche d'une limite qui définit la notion de zéro absolu. En effet, en thermodynamique classique, ce principe permet de calculer l'entropie molaire S d'un corps pur par intégration sur la température à partir de S=0 à 0 K dans le but d'établir des tables de données thermodynamiques.
La loi de Laplace en thermodynamique
En thermodynamique, cette loi correspond à une relation reliant la pression et le volume d'un gaz parfait qui subit une transformation dite isentropique ou une transformation dite adiabatique et réversible. Mais cette relation peut également être utilisée avec la température et le volume ainsi que la température et la pression.
La loi de Laplace suppose en effet des capacités thermiques constante alors que les capacités thermiques d'un gaz parfait dépend évidemment de la température, il suffit de regarder la loi des gaz parfait. En conséquence, cette loi ne peut être appliquée à des transformation où la variation de la température est peu important. On peut alors considérer que les capacités thermiques sont constantes.
[ P times V = n times R times T ]
Avec :
- P est la pression d'un gaz (en pascals) ;
- V le volume occupé par le gaz (en m3) ;
- n la quantité de matière (en moles) ;
- R la constante universelle des gaz parfaits (8,3144621 J/K/mol) ;
- Et T est la température (en kelvins).
La thermochimie

La thermochimie correspond à une branche de la physique chimie et permet l'étude des différents phénomènes thermiques dans des milieux réactionnels. On peut positionner cette branche, sur le plan disciplinaire, à l'interface entre la chimie et la thermodynamique.
En chimie, il existe différents types de réactions : les réactions dites exothermiques et qui dégagent donc de la chaleur et les réactions dites endothermiques qui, quant à elles, absorbent la chaleur. Il est possible de déterminer et mesurer les chaleurs de réactions par calorimétrie à pression constante dans un calorimètre ou encore à volume constant dans une bombe calorimétrique.
La bombe calorimétrique, inventée en 1881 par Marcellin Berthelot, est un outil permettant de mesurer le pouvoir calorifique d'une combustible. C'est pour cela que Marcellin Berthelot est considéré comme étant le fondateur de la thermochimie. Même s'il faudra attendre le XXe siècle que la thermochimie se développera considérablement.
En appliquant le deuxième principe de la thermodynamique aux systèmes chimiques, il est possible de prévoir le sens des réactions mais aussi le positionnement des équilibres chimiques et ainsi de définir le rendement et la composition d'un système après la réaction.
Règle de sécurité en synthèse organique
La synthèse organique nécessite de prendre des précautions afin de ne pas s'exposer à des produits dangereux pour la santé et de ne pas provoquer d' accidents (incendie, explosion...).
Tout d'abord la réaction doit se faire sous une aspiration (hotte aspirant, Boa aspirant) afin que les vapeurs de produit ne soit pas massivement respirées. Aussi, le port d'équipement personnel de protection est requis :
- la blouse protège la peau et vêtement.
- Le port de jupe, de short et de nus pieds sont prohibés.
- Des lunettes doivent être portée pour protéger les yeux des brûlures. Par exemple, les composés basiques sont extrêmement dangereux et peuvent faire perdre la vue. Les lentilles sont interdites car certains produits pourraient les faire fondre dans l’œil.
- Le port de gants est obligatoire afin d'éviter que les produits chimiques ne provoquent des brûlures ou ne pénètre dans l'organisme.
Avant de commencer, il est important de lire les fiches de données de sécurité de chaque produit ou solvant utilisés. Ces fiches résument tous les risques (santé, accidents) associés aux produits utilisés et donne les préconisations en cas d'accident.
Au niveau de la sécurité des lieux, il est indispensable de connaitre les sorties de secours, la position des extincteurs...
Exemples de réactions chimiques
Parmi les réactions chimiques classiquement étudiées en chimie organique, il y la réaction d'estérification. Cette réaction est réversible et la réaction inverse est appelée saponification, qui est la réaction de base de fabrication du savon.
Par exemple, la fabrication de l'aspirine résulte d'une réaction d'estérification, c'est-à-dire de la réaction d'un acide carboxylique ou anhydride sur une fonction alcool. La réaction de saponification résulte quant à elle de l'attaque basique sur un ester (une triglycéride est un tri-ester)

Les transformations via les réactions d'oxydoréduction
Une réaction d'oxydoréduction, également appelée réaction redox, correspond à une réaction chimique au cours de laquelle a lieu un transfert d'électron. C'est-à-dire une réaction durant laquelle une espèce chimique dite oxydant reçoit un ou plusieurs électrons d'une autre espèce chimique dite réducteur.

Un oxydant, également appelé agent d'oxydation, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, reçoit un ou plusieurs électrons d'une autre espèce chimique. Lavoisier mettra en évidence en 1772, suite à ses manipulations du mercure, le rôle du dioxygène dans certaines réactions d'oxydoréduction. D'où le nom oxydation qui signifie "combinaison avec l'oxygène".
Un réducteur, également appelé agent de réduction, correspond à un ion, un corps simple ou un composé qui, lors d'une réaction d'oxydoréduction, cède un ou plusieurs électrons à une autre espèce chimique. Réduction quant à lui signifie "l'extraction d'un métal de son oxyde", une définition connue en métallurgie.
Les réactions d'oxydo-réduction forment une grande famille puisqu'elles comprennent de nombreuses réactions chimiques. En effet, elles interviennent dans les combustions, certains dosages métallurgiques mais également la corrosion des métaux, l'électrochimie et la respiration cellulaire.
Ces réactions sont alors essentielles puisqu'elles jouent un rôle fondamental en biologie : elles permettent la transformation de l'oxygène en eau, de formule H2O, au sein des organismes vivants. Elles sont également massivement utilisées dans l'industrie humaine, notamment afin d'obtenir de la fonte à partir de différents minerais composés d'oxyde de fer grâce à une réduction, puis de fer et d'acier à partir de la fonte grâce à une réaction d'oxydation.
Ces différentes utilisations peuvent être expliquée par l'extrême mobilité de l'électron, sa légèreté mais également son omniprésence dans toutes les formes de la matière.
Les demi-équations
Puisque dans une réaction d'oxydo-réduction, le réducteur s'oxyde, c'est la réaction d'oxydation et l'oxydant se réduit, c'est la réaction de réduction, l'oxydoréduction se compose donc de deux demi-réactions : une oxydation et une réduction.
Elles se présentent sous la forme suivante :
- Oxydation
- réducteur(1) = oxydant(1) + n e-
- Réduction
- oxydant(2) + n e- = réducteur(2)
- Oxydoréduction qui représente donc la "somme" de l'oxydation et de la réduction
- oxydant(2) + réducteur(1) → oxydant(1) + réducteur(2)
Notons que dans les demi-équation, les flèches n'apparaissent que si la réaction est totale, c'est à dire quand K > 10 000
Le potentiel d'oxydo-réduction
Le caractère oxydant ou réducteur d'une espèce dépend de la réaction chimique et des espèces qui interagissent entre elles. En effet, l'élément réducteur dans une réaction peut devenir l'oxydant d'une autre réaction. C'est pour cela que l'on construit une échelle de force oxydante (ou de force réductrice selon le sens donné à cette échelle) afin d'obtenir le potentiel d'oxydo-réduction se mesurant en volt.
En outre, le potentiel d'oxydo-réduction dépend du contexte chimique, notamment du pH, mais aussi du contexte physique puisque les effets de la lumière peuvent intervenir dans la nature comme ce qui est le cas avec la photosynthèse chez les plantes ou la photographie avec l'Homme.
Les transformations via les réactions acido-basiques
Acide et base selon Brönsted
Un acide est une espèce chimique capable de céder un proton H+.
[ AH rightleftarrows A ^ { - } + H ^ { + } ]
Une base est une espèce chimique capable de capter un proton H+.
[ B + H ^ { + } rightleftarrows BH ^ { + } ]
On obtient donc une réaction acido-basique :
[ AH + B rightleftarrows A ^ { - } + BH ^ { + } ]
Dans cet exemple, on peut alors parler de :
- Couple AH/A-
- Couple BH+/B
Il y a un transfert d'un proton H+ entre l'acide d'un couple et la base d'un autre couple.
A chaque acide est associé une base qui est dite base conjuguée (réciproquement). Les deux forment un couple Acide/Base.
Le pH
Le pH, ou encore potentiel hydrogène, correspond à une mesure de l'activité chimique de ce qu'on appelle les hydrons dans une solution. Mais vous les connaissez plus certainement sous le nom de protons ou encore ions hydrogènes. De façon plus particulière, ces protons, dans une solution aqueuse, se présent sous la forme de l'ion hydronium qui représente le plus simple des ions oxonium.
Le pH est, le plus souvent, utilisé afin de mesurer l'acidité ou encore la basicité de la solution. On peut alors la déterminer avec l'échelle suivant dans le cas d'un milieu aqueux à 25°C :
- une solution de pH égal à 7 est considérée comme étant neutre ;
- une solution de pH inférieur à 7 est considérée comme étant acide. De ce fait, plus son pH diminue, plus elle est acide ;
- une solution de pH supérieur à 7 est considérée comme étant basique. De ce fait, plus son pH augmente, plus elle est basique.
Mais la définition que nous connaissons aujourd'hui du pH, définition de Sorensen, n'a été officiellement reconnue qu'à partir du milieu du XXe siècle par l'UICPA.
L’UICPA, l’Union Internationale de Chimie Pure et Appliquée est une organisation non gouvernementale ayant son siège à Zurich, en Suisse. Créée en 1919, elle s’intéresse au progrès de la chimie, de la chimie physique et de la biochimie. Ses membres sont les différentes sociétés nationales de chimie et elle est membre du Conseil International pour la Science.
L’UICPA est une autorité reconnue dans le développement des règles à adopter pour la nomenclature, les symboles et autres terminologies des éléments chimiques et leurs dérivés via son Comité Interdivisionnel de la Nomenclature et des Symboles. Ce comité fixe la nomenclature de l’UICPA.
Cette définition est donc celle que nous retrouvons dans les manuels scolaires et s'énonce ainsi :
[ pH = - log left( a _ { text { H } } right) ]
Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH.
Néanmoins, cette définition ne nous permet pas d'obtenir des mesures directes du pH ni même des calculs. En effet, le pH dépend uniquement de l'activité des ions hydrogènes. De ce fait, le pH dépend de plusieurs autres facteurs découlant de cette activité. On peut par exemple parler de l'influence du solvant ou encore de la température.
Il reste cependant possible d'obtenir des valeurs approchées du pH en utilisant ce calcul. Pour cela, il est nécessaire de faire appel à des définitions de l'activité.
Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogène induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant. Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul, à l’aide de définitions plus ou moins exactes de l’activité.
Remarque :
le p de pH représente la fonction "- log" donc ici - log (H). Donc si on parle de pOH ou de pKa, cela signifie que l'on parle de - log (OH) et de - log (Ka).























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Le courage, intelligences , savoir connaître l’origine sont des moyens d’apprendre plus facilement les notions physique et chimie pour mise en œuvre
Bonjour,
Je pense qu’il y a une petite erreur dans la partie exemple de groupements réactifs, sur la formule semi-développée de Acides carboxylique (-COOH) dans le tableau il y a celle de la formule de l’aldéhyde (-CHO) à la place.
Autrement, merci pour ce cours qui est très claire