Chapitres
- 01. La formule du pH ?
- 02. La mesure du pH ??
- 03. Comment calculer le pH ? ⚛️
- 04. Valeurs du pH ?
- 05. pH : exercices ?
- 06. Corrections ✍️
Le "pH", abréviation de "potentiel Hydrogène", est une grandeur qui reflète la proportion d'ions oxonium (aussi appelés ions hydronium) de formule H3O+ (molécule d'eau + ion d'hydrogène) présents dans une solution aqueuse. Le pH va permettre de déterminer si une solution aqueuse est acide ou basique.
Le pH est mesuré sur une échelle allant de 0 à 14 :
Un pH inférieur à 7 indique une solution acide
Un pH égal à 7 est neutre
Un pH supérieur à 7 indique une solution basique
| Type de Solution | Étape | Relation Utilisée | Calcul | Interprétation pH |
|---|---|---|---|---|
| Acide Faible | Dissociation Partielle de l'Acide | -log[H3O+] | -log[Concentration Acide] | pH < 7 (Acide) |
| Base Forte | Dissociation Complète de la Base | 14 - pOH | -log[Concentration Base] | pH > 7 (Basique) |

La formule du pH ?

? L'acidité d'une solution est donc liée à la présence des ions oxonium et dépend de leur concentration. Plus cette concentration est élevée, plus la solution est acide.
Pour information, cette concentration est de l'ordre de 1 mol.L-1 pour les solutions les plus acides et peut descendre jusqu'à 10-14 mol.L-1 pour les solutions les moins acides (= les plus basiques).
Le pH, ou potentiel hydrogène, a été introduit par le chimiste danois Søren Peder Lauritz Sørensen en 1909. Il a défini le pH comme le logarithme négatif de base 10 de l'activité des ions hydrogène dans une solution, exprimée en mol par litre. Ainsi, la formule du pH est pH = -log[H⁺], où [H⁺] représente la concentration des ions hydrogène dans la solution. Cette définition que nous connaissons aujourd'hui du pH n'a été officiellement reconnue qu'à partir du milieu du XXe siècle par l'UICPA (Union Internationale de Chimie Pure et Appliquée).
Afin d'exprimer l'acidité par une grandeur plus simple que la concentration des ions oxonium, une échelle appelée l'échelle de pH a été définie.
➡️ Elle est caractérisée par la relation suivante : pH = - Log [H3O+] où :
La concentration [H3O+] est exprimée en mol.L-1
Le pH est un nombre sans unité
La mesure du pH ??
Deux méthodes de mesure du pH sont à connaître :
La mesure du pH à l'aide de papier pH
La mesure du pH à l'aide d'un pH-mètre
Comment utiliser le papier pH ? ?

? L'utilisation du papier pH est assez simple, mais ne donne qu'une valeur approximative du pH. La mesure à l'aide du papier pH consiste à tremper le papier pH dans la solution dont on veut connaître le pH.
? Le papier change quasi-instantanément de couleur. Il suffit alors de comparer la couleur du papier pH à l'échelle de couleurs se trouvant sur la boîte du papier pH afin de déterminer une valeur approximative du pH.
Le papier pH est en particulier très utile pour avoir une idée du milieu dans lequel on se trouve (très acide, acide, neutre, basique ou très basique).
Comment utiliser un pH-mètre ? ??
? Le pH-mètre, quant à lui, va donner une valeur plus précise du pH. Cet appareil est constitué d'une sonde de pH qui est mise au contact de la solution dont on souhaite mesurer le pH.
Son utilisation nécessite un étalonnage réalisé à l'aide de deux ou trois solutions dites "tampons" pour lesquelles le pH est déjà connu. La mesure d'un pH à l'aide du pH-mètre a une précision qui dépend de la qualité de l'étalonnage mais elle est en général de l'ordre de 0,1 unité pH.
@aucoeurduchaudron Répondre à @marion.coaching Comment je mesure le pH d'un savon ? ? #savonnerie #zerodechet #artisan ♬ Two Weeks - Grizzly Bear
Comment calculer le pH ? ⚛️
A partir de l'ensemble des relations exposées plus haut dans ce cours, il est possible de calculer le pH de diverses solutions.
Calculer le pH à partir d'une solution d'acide fort ?
Prenons l'exemple d'une solution aqueuse d'acide chlorhydrique HCl, de concentration 1.10-3 mol/L.
➡️ L'équation de la réaction est la suivante : HCl + H2O -> Cl- + H3O+ S'agissant de la réaction d'un acide fort dans l'eau, la conversion est totale et [Cl- ] = [H3O+] = 1.10-3 mol/L.
À partir de la relation entre le pH et la concentration en ions oxonium, il est possible d'en déduire le pH : pH = - log([[H3O+]) = - log(1.10-3 ) = 3 Le pH de cette solution aqueuse est donc égal à 3 et nous sommes en présence d'un acide fort car le pH est très largement inférieur à 7.

Les acides sont des substances libérant des protons dans l'eau. Les acides faibles, tels que l'acide acétique, le font partiellement, tandis que les acides forts, comme l'acide chlorhydrique, le font complètement. La différence réside dans la capacité à libérer des protons, influençant ainsi leur réactivité et leur impact sur le pH de la solution. Les acides faibles libèrent des protons de façon limitée, comme l'acide acétique dans le vinaigre, tandis que les acides forts, comme l'acide chlorhydrique, le font de manière plus complète, influençant ainsi l'intensité de leur action chimique dans une solution.
Calculer le pH à partir de la concentration en ions hydroxyde ⚗️
Prenons l'exemple d'une solution de concentration en ions hydroxyde [OH-] = 1.10-2 mol/L.
➡️ À partir de cette concentration en ions hydroxyde, il est possible de calculer le pOH de la solution : pOH = - log([OH-]) = - log(1.10-2) = 2
Pour finir, en utilisant la relation qui lie le pH au pOH, il est possible d'en déduire le pH de cette solution : pH = 14 - pOH = 14 - 2 = 12 Ainsi, le pH de la solution est égal à 12, et il s'agit donc d'une base forte car le pH est très largement supérieur à 7.
@pheasyc #chimie #pH #spechimie #passetonbacdabord #spechimie #revisetonbac #pourtoi #oxonium ♬ son original - pheasyc
La fonction Logarithme ?
f(x) = Log ( x ) correspond à la fonction logarithme décimal, définie à partir du logarithme népérien par la relation suivante : 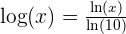 Si x = 10a , alors
Si x = 10a , alors  Soit,
Soit, 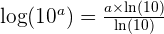 Et donc
Et donc  La fonction réciproque du logarithme décimale est f(x) = 10x Ainsi, si y = Log (x) alors x = 10y
La fonction réciproque du logarithme décimale est f(x) = 10x Ainsi, si y = Log (x) alors x = 10y
➡️ Rapporté au pH, cela signifie que si pH = - Log([H3O+]) alors [H3O+] = 10-pH
Valeurs du pH ?
? D'après la relation entre la concentration en ions oxonium et le pH, on peut en déduire que :
- Si [H3O+] = 1 mol.L-1 alors pH = - Log (100) et donc pH = 0
- Si [H3O+] = 10-1 mol.L-1 alors pH = - Log (10-1) et donc pH = 1
- Si [H3O+] = 10-2 mol.L-1 alors pH = - Log (10-2) et donc pH = 2
- Si [H3O+] = 10-3 mol.L-1 alors pH = - Log (10-3) et donc pH = 3
Et ainsi de suite jusqu'à la concentration [H3O+] = 10-14 mol.L-1 où pH = 14.

⚠️ Ainsi, plus la concentration en ions oxonium est faible, plus le pH augmente et plus la solution est basique.
Inversement, plus la concentration en ions oxonium est importante, plus le pH diminue et plus la solution est acide.
À noter qu'à chaque fois que la concentration en ions oxonium est divisée par dix, le pH augmente d'une unité. Inversement, la valeur du pH d'une solution permet d'en déduire la concentration en ions oxonium, car ils sont liés par la relation [H3O+] = 10-pH
pH : exercices ?
Exercice 1️⃣
Questions de cours
- Qu'est-ce que le pH et quel est son rôle dans la caractérisation d'une solution aqueuse ?
- Qui a introduit le concept de pH, et comment est-il défini ? Expliquez brièvement la formule du pH.
- Quelle est la différence fondamentale entre un acide faible et un acide fort ? Donnez un exemple de chaque.
- Comment mesure-t-on le pH d'une solution à l'aide du papier pH ? Quelles informations peut-on obtenir avec cette méthode ?
- Quels sont les deux paramètres nécessaires pour calculer le pH d'une solution à l'aide d'un pH-mètre ?
- Expliquez le processus d'étalonnage d'un pH-mètre et son importance dans la mesure du pH.
- À partir de l'équation de réaction d'un acide fort dans l'eau, comment peut-on calculer le pH d'une solution d'acide chlorhydrique de concentration donnée ?
- Pour une solution basique de concentration en ions hydroxyde donnée, comment peut-on calculer le pH en utilisant le pOH ?
- Quelle est la fonction logarithmique associée au pH, et comment est-elle utilisée pour calculer la concentration en ions oxonium à partir du pH ?
- Comment évolue le pH à mesure que la concentration en ions oxonium diminue dans une solution ? Expliquez brièvement.
Exercice 2️⃣
Évaluation du pH d'une solution d'acide faible
Considérons une solution aqueuse d'acide acétique (CH₃COOH) de concentration 0,01 mol/L. Étant donné que l'acide acétique est un acide faible, déterminez le pH de cette solution en utilisant la relation qui lie le pH à la concentration en ions oxonium. Indiquez également si la solution est acide, basique ou neutre.
Corrections ✍️
Exercice 1️⃣
- Le pH mesure l'acidité ou la basicité d'une solution en fonction de la concentration d'ions oxonium. Une solution acide a un pH inférieur à 7, neutre à pH 7, et basique à pH supérieur à 7.
- Le pH a été introduit par Søren Peder Lauritz Sørensen en 1909. Il est défini comme le logarithme négatif de base 10 de l'activité des ions hydrogène dans une solution : "pH = -log[H+]".
- La différence entre un acide faible et un acide fort réside dans leur capacité à libérer des protons. Un exemple d'acide faible est l'acide acétique (CH₃COOH), tandis que l'acide chlorhydrique (HCl) est un exemple d'acide fort.
- Le papier pH mesure le pH d'une solution en changeant de couleur. On obtient une valeur approximative en comparant cette couleur à l'échelle fournie sur la boîte du papier pH.
- Les deux paramètres nécessaires pour calculer le pH d'une solution à l'aide d'un pH-mètre sont la concentration d'ions hydronium ([H₃O⁺]) et l'étalonnage du pH-mètre avec des solutions tampons de pH connu.
- L'étalonnage d'un pH-mètre implique l'utilisation de solutions tampons de pH connu pour ajuster et calibrer le pH-mètre. Cela garantit une mesure précise du pH.
- Pour calculer le pH d'une solution d'acide fort, on peut utiliser la relation "pH = -log[H₃O⁺]" en considérant que la conversion de l'acide est totale.
- Pour une solution basique de concentration en ions hydroxyde donnée, on peut calculer le pH en utilisant le pOH ("pOH = -log[OH⁻]") et la relation "pH = 14 - pOH".
- La fonction logarithmique associée au pH est "f(x) = -log(x)". Elle est utilisée pour calculer la concentration d'ions oxonium ([H₃O⁺]) à partir du pH : "[H₃O⁺] = 10^(-pH)".
- À mesure que la concentration d'ions oxonium diminue dans une solution, le pH augmente. Chaque diminution d'un facteur de 10 dans la concentration entraîne une augmentation d'une unité de pH.
Exercice 2️⃣
La réaction d'un acide faible comme l'acide acétique dans l'eau est partiellement dissociée. L'équation de réaction est CH₃COOH + H₂O → CH₃COO⁻ + H₃O⁺.
La concentration à l'équilibre de H₃O⁺ est égale à la concentration initiale de l'acide acétique, soit 0,01 mol/L. En utilisant la relation pH = -log[H₃O⁺], nous pouvons calculer le pH : pH = -log(0,01) = 2. La solution est donc acide car le pH est inférieur à 7.
À présent, vous voici un as du pH ! À vous de jouer !























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Good job. Focus
J’adore vraiment assez superprof
Merci François ! 🙂
Aidez moi à résoudre ces exercices svp : -quel est le ph de H2so4 dans les cntp.
-Quelle est la concentration d’une solution de H2so4 dont le ph =2,3.
-Calculez le pH d’une solution HNO3 10^-7,7 N .
-Pourquoi l’échelle de ph d’une solution aqueuse a 14 unités ?
-Démontrez par des calculs mathématiques que le ph d’une solution aqueuse acide est inférieur à 7
– Démontrez par des calculs mathématiques que le ph d’une acqueuse neutre égale à 7
– Démontrez par des calculs mathématiques que le ph d’une solution aqueuse basique est supérieur à 7 . Aidez moi svp ces urgent 🙏
Bonjour, nous serions ravis de vous aider ! Rendez-vous sur la plateforme de Superprof, sélectionnez la rubrique « Découvrir nos Superprofs » en indiquant la matière souhaitée. Vous trouverez de nombreux professeurs près de chez vous. Bonne journée ! 🙂
Bonjour, aidez-moi à calculer ça: on donne HCL pH=3,3. On demande de calculer: N, M, G/L et T
Bonjour,
La concentration molaire volumique en ion H2O+ peut être calculée en utilisant la formule suivante:
Concentration molaire volumique en H2O+ (mol/L) = Nombre de moles d’H2O+ / Volume de la solution (L)
Attention cependant, H2O+ n’existe pas sous forme isolée, mais plutôt sous forme d’hydrates tels que H3O+. La concentration molaire volumique en H3O+ peut être utilisée comme approximation de la concentration molaire volumique en H2O+.
Bonne journée,
Clément