Chapitres
? Le pH et le pKa sont des notions fondamentales en chimie. Elles permettent d'expliquer les réactions des acides et des bases en présence d'eau.
- Le pH est une mesure de l'acidité ou de la basicité d'une solution. Il est déterminé par la concentration en ions H+ (protons) dans la solution. Les acides libèrent des protons dans l'eau, abaissant ainsi le pH, tandis que les bases acceptent des protons, augmentant le pH. Un pH inférieur à 7 indique une solution acide, un pH égal à 7 est neutre, et un pH supérieur à 7 est basique.
- Le pKa, quant à lui, est une constante d'acidité qui révèle la tendance d'une molécule à libérer un proton (H+) dans une solution. Plus le pKa est bas, plus l'acide est fort, car il a une forte propension à libérer des protons. En revanche, les bases fortes ont des pKa élevés.
Les réactions des acides et des bases avec l'eau sont donc essentiellement des transferts de protons.
| Concept/Notion | Description |
|---|---|
| pH | Mesure de l'acidité ou de la basicité d'une solution. |
| pKa | Constante d'acidité indiquant la force d'un acide. |
| Réaction acido-basique | Processus de transfert de protons entre acides et bases. |
| Hydronium (H3O+) | Ion formé lorsque l'eau accepte un proton d'un acide. |
| Ion hydroxyde (OH-) | Ion formé lorsque l'eau libère un proton en réaction avec une base. |
| Acides forts et faibles | Acides ayant des pKa bas ou élevés déterminant leur force. |
| Bases fortes et faibles | Bases ayant des pKa élevés ou bas influençant leur force. |
| Neutralisation | Mélange d'un acide et d'une base pour former de l'eau et un sel neutralisant les propriétés acides et basiques. |
| Régulation du pH | Ajustement du pH d'une solution en ajoutant des acides ou des bases pour maintenir un pH spécifique. |
| Applications pratiques | Utilisation des concepts de pH et pKa dans divers domaines tels que la chimie, la biologie, la pharmacologie, l'alimentation et la régulation environnementale. |

Définition du pH, ou potentiel hydrogène ?
Le pH, ou encore potentiel hydrogène, correspond à une mesure de l'activité chimique de ce qu'on appelle les hydrons dans une solution.
Mais vous les connaissez plus certainement sous le nom de protons ou encore ions hydrogènes.
De façon plus particulière, ces protons, dans une solution aqueuse, se présentent sous la forme de l'ion hydronium qui représente le plus simple des ions oxonium.
⚗️ Le pH est, le plus souvent, utilisé afin de mesurer l'acidité ou encore la basicité de la solution. On peut alors la déterminer avec l'échelle suivant dans le cas d'un milieu aqueux à 25°C :
Une solution de pH égal à 7 est considérée comme étant neutre
Une solution de pH inférieur à 7 est considérée comme étant acide. De ce fait, plus son pH diminue, plus elle est acide
Une solution de pH supérieur à 7 est considérée comme étant basique. De ce fait, plus son pH augmente, plus elle est basique
Mais la définition que nous connaissons aujourd'hui du pH, définition de Sørensen, n'a été officiellement reconnue qu'à partir du milieu du XXe siècle par l'UICPA.
S.P.L. Sørensen, dont le nom complet est Søren Peter Lauritz Sørensen, était un chimiste danois né le 9 janvier 1868 et décédé le 12 février 1939. Il est surtout connu pour son travail dans le domaine de la chimie analytique et de la mesure du pH. Sørensen a effectué des recherches importantes sur les mesures de l'activité des ions hydrogène (H+) dans les solutions, ce qui a conduit à sa définition du pH en 1909 : "Le pH est le négatif du logarithme décimal de l'activité des ions hydrogène (H+) dans une solution."

L'UICPA, ou Union Internationale de Chimie Pure et Appliquée, est une organisation internationale fondée en 1919, qui s'occupe de la standardisation et de la nomenclature en chimie. Elle a pour mission de promouvoir la chimie pure et appliquée, ainsi que de faciliter la collaboration entre les chimistes du monde entier.
L'une des contributions les plus importantes de l'UICPA à la chimie est la publication de recommandations et de règles pour la nomenclature chimique. Les directives de nomenclature de l'UICPA couvrent divers domaines, tels que la nomenclature des composés organiques, inorganiques, polymères, et bien d'autres.
L'UICPA est également responsable de l'attribution des noms officiels pour les éléments chimiques et a une influence significative sur la normalisation et la terminologie chimique à l'échelle mondiale.
? Cette définition est donc celle que nous retrouvons dans les manuels scolaires et s'énonce ainsi :
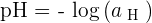
Avec aH, également noté aH+ ou [H+], qui correspond à l'activité des ions hydrogène H+. aH correspond donc à une grandeur sans dimension tout comme le pH.
Néanmoins, cette définition ne nous permet pas d'obtenir des mesures directes du pH ni même des calculs. En effet, le pH dépend uniquement de l'activité des ions hydrogènes. De ce fait, le pH dépend de plusieurs autres facteurs découlant de cette activité.
➡️ On peut par exemple parler de l'influence du solvant ou encore de la température.
Il reste cependant possible d'obtenir des valeurs approchées du pH en utilisant ce calcul. Pour cela, il est nécessaire de faire appel à des définitions de l'activité.
? Cette définition formelle ne permet pas des mesures directes de pH, ni même des calculs. Le fait que le pH dépende de l’activité des ions hydrogène induit que le pH dépend de plusieurs autres facteurs, tels que l’influence du solvant.
Toutefois, il est possible d’obtenir des valeurs approchées de pH par le calcul, à l’aide de définitions plus ou moins exactes de l’activité.

pH : une nouvelle définition ?
Aujourd'hui, une autre définition du pH a été donnée par l'UICPA. Cette définition, déterminée grâce à une méthode électrochimique expérimentale, consiste à utiliser la relation de Nernst dans une cellule électrochimique définie comme qui suit :
Électrode de référence | Solution de KCl concentré | Solution X | H2 | Pt (électrode à hydrogène)
La relation de Nernst est une équation utilisée en électrochimie pour décrire comment le potentiel électrique d'une cellule électrochimique dépend de la concentration des ions impliqués dans la réaction. Elle est couramment utilisée pour prédire les potentiels électrochimiques et la réponse des électrodes dans diverses applications. L'équation de Nernst est E = E° - (RT/nF) * ln(Q), où E est le potentiel électrique, E° est le potentiel standard, R est la constante des gaz parfaits, T est la température, n est le nombre d'électrons échangés, F est la constante de Faraday, et ln(Q) est le logarithme du quotient de réaction Q.
Ainsi, via des mesures de ce qu'on appelle force électromotrice, également notée fem ou f.e.m., de la cellule avec une solution de référence notée S, on peut obtenir la relation suivante : 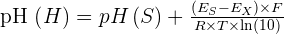
Avec :
| Variable | Description |
|---|---|
| pH(X) | Le pH de la solution inconnue X. |
| pH(S) | Le pH tabulé de la solution de référence S. |
| E(X) | La force électromotrice (f.e.m.) de la cellule avec la solution inconnue X. |
| E(S) | La f.e.m. de la cellule avec la solution de référence S à la place de la solution X. |
| F | La constante de Faraday, égale à 96 485 C mol⁻¹. |
| R | La constante universelle des gaz parfaits, égale à 8,314 472 J mol⁻¹. |
| T | La température absolue en kelvins. |
Définition d'un acide faible ?
? Un acide est dit "faible" si, en présence d'eau, s'établit un équilibre où coexistent l'acide et sa base conjuguée.
➡️ Si AH est un acide faible ayant pour base conjuguée A-, alors cette dernière est également dite "faible" et il s'établit l'équilibre décrit par l'équation de réaction suivante :
H2O +AH  H3O+ + A-
H3O+ + A-
L'acide du couple acido-basique AH/A- réagit avec la base du couple H3O+/H2O.
? Remarques :
Pour obtenir la base conjuguée d'un acide, il suffit de retirer un proton H+ à cet acide
Dans une réaction acido-basique, l'acide d'un couple acido-basique réagit toujours avec la base d'un autre couple acido-basique.
La constante d'acidité Ka ⚛️
Définition ?
? Le Ka correspond à la constante d'acidité, encore appelée constante de dissociation acide.
? Elle permet la mesure quantitative de la force d'un acide en solution.
En effet, cette constante permet également de connaître l'équilibre d'une espèce acide dans le cadre d'une réaction acido-basique.
➡️ De cette façon, plus le Ka est élevée, plus la dissociation des molécules en solution est grande.
On peut alors dire que la force d'un acide est proportionnelle au Ka.

Formule ✒️
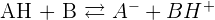
Avec :
Couple AH/A-
Couple BH+/B
On considère alors que AH correspond à un acide générique qui va, en se dissociant, donner l'acide A- qui est sa base conjuguée, ainsi qu'un ion hydrogène H+ que l'on appelle également proton. Si la réaction se déroule dans un milieu aqueux, ce proton devient un proton solvaté H3O+.
Lorsque l'acide AH et la base A- d'un couple sont faibles, alors l'équilibre qui existe entre ces deux formes en solution aqueuse est décrit par la relation suivante :

où
Les concentrations [A-], [H3O+] et [AH] sont exprimées en mol.L-1
Ka est appelée constante d'acidité. Il s'agit d'une grandeur sans unité qui dépend de la température et qui est propre à chaque couple acide-base.
Le pKa d'un couple acide-base ?

? Le pKa d'un couple acide base est défini par la relation suivante : pKa = - Log (Ka).
Le pKa va permettre de déterminer la force d'un acide.
En effet, plus l'acide est fort, plus sa réaction avec l'eau est importante voire totale pour former des ions oxonium H3O+ donc plus le Ka est élevé et, par conséquent, plus le pKa est faible.
En plus de ces constantes, il en existe d'autres très présentes en chimie, vous les trouverez dans le tableau qui suit :
| Constante d'équilibre | Symbole | Type d'équilibre |
|---|---|---|
| Produit de solubilité | ks | Équilibre hétérogène entre une substance faiblement soluble et ses ions dans une solution saturée |
| Constante de complexation | ßn | Formation d'un ion complexe |
| Constante de partage, aussi appelée constante de distribution | kD | Équilibre de distribution entre des solvants non miscibles |
| Produit ionique de l'eau | Ke | Dissociation de l'eau |
| Constante de dissociation (acidité et basicité) | ka et kb | Dissociation d'un acide faible ou d'une base faible |
Définition d'une base faible ?
De la même manière que pour l'acide faible, on dit qu'une base est "faible" si, en présence d'eau, s'établit un équilibre où coexistent la base et son acide conjugué. Cet équilibre est décrit par l'équation de réaction suivante :
H2O + A- 
La base du couple acido-basique AH/A- réagit avec l'acide du couple H2O/OH-.
Exemples de bases faibles ?
- Ammoniac (NH3)
- Hydrogénocarbonate (ou bicarbonate) (HCO3-)
- Acétate (CH3COO-)
- Pyridine (C5H5N)
- Aniline (C6H5NH2)
- Éthylamine (C2H5NH2)
- Hydrogénosulfite (HSO3-)
- Hydrogénosulfure (HS-)
- Cyanure (CN-)
- Acide borique (H3BO3) - fonctionne comme une base de Lewis dans certains contextes.
On retiendra que plus une base est forte, plus son Ka est petit et donc plus son pKa est grand. C'est tout simplement l'inverse par rapport aux acides.
Diagramme de prédominance ?
Un diagramme de prédominance est un graphique qui montre quelles espèces chimiques sont prédominantes à différents niveaux de pH dans une solution.
? Il permet de visualiser comment l'équilibre entre les acides, les bases et leurs formes conjuguées évolue en fonction du pH. Ces diagrammes sont essentiels pour comprendre le comportement acido-basique des solutions et sont largement utilisés en chimie pour prédire les réactions chimiques dans des conditions variées de pH.
? Relation entre le pH et le pKa
? Le pKa est une grandeur qui permet également de déterminer, pour une valeur de pH donnée, le membre prédominant d'un couple acide base.
➡️ En effet :

- Donc

- Soit,

- Ou encore

- On pourra finalement retenir que

? Les trois zones de prédominance
À partir de la relation entre le pH et le pKa, trois zones distinctes de prédominance vont pouvoir être mises en évidence :

Cas n°1 : pH = pKa
Si pH = pKa, alors 
Soit  (car log(1) = 0)
(car log(1) = 0)
Cela signifie donc que les concentrations de l'acide et de sa base conjuguée sont identiques : [AH ] = [A-]
Cas n°2 : pH < pKa
Si pH < pKa, alors 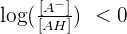
Soit 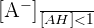 (d'après les variations de la fonction f(x) = log(x))
(d'après les variations de la fonction f(x) = log(x))
Cela signifie donc que la concentration de la base conjuguée est inférieure à la concentration de l'acide (ou encore que la concentration de l'acide est supérieure à la concentration de sa base conjuguée :
[A-] < [AH] => [AH] > [A-]
On dit que la forme acide est prédominante sur la forme basique.
Cas n°3 : pH > pKa
Si pH > pKa, alors

Soit 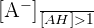 (d'après les variations de la fonction f(x) = log(x))
(d'après les variations de la fonction f(x) = log(x))
Cela signifie donc que la concentration de la base conjuguée est supérieure à la concentration de l'acide (ou encore que la concentration de l'acide est inférieure à la concentration de sa base conjuguée) :
[A-] > [AH] => [AH] < [A-]
On dit que la forme basique est prédominante sur la forme acide.
?? Diagramme de prédominance
Précédemment, trois zones de prédominance ont été définies :
Si pH < pKa alors [AH ] > [A-] : la forme acide est prédominante
Si pH = pKa alors [AH ] = [A-] : aucune forme ne prédomine par rapport à l'autre
Si pH > pKa alors [AH ] < [A-] : la forme basique est prédominante
Ces résultats peuvent être traduits par le diagramme de prédominance suivant :

Les acides forts ?
@chimiechic Qu’est-ce qu’un acide en chimie ? #acide #acidefort #acidefaible #acideorganique #chimie #chimiechic #science #sciencepourtous #apprendre #savoirdujour #savoir #sciencephysique #vulgarisationscientifique #lycée #bac #apprendreautrement #academietiktok #tiktokacademie ♬ son original - Chimie Chic
Définition d'un acide fort ?
Un acide est dit "fort" si sa réaction avec l'eau peut être considérée comme totale et qu'il ne subsiste alors en solution que sa base conjuguée.
Pour vérifier qu'une réaction chimique est totale, on peut observer si les réactifs initiaux sont complètement consommés, comparer les quantités de réactifs initiales aux quantités de produits obtenues, surveiller la cinétique de la réaction, étudier les produits formés, calculer le rendement, analyser la constante d'équilibre, et réaliser des expériences sous différentes conditions. La totalité d'une réaction dépend des circonstances spécifiques, et diverses méthodes peuvent être utilisées pour la confirmer.
➡️ La réaction de cet acide fort AH avec l'eau peut alors se traduire par l'écriture de l'équation bilan suivante :
AH + H2O → A- + H3O+
La flèche dirigée vers la droite indique simplement que la réaction chimique ne se réalise que dans un seul sens.
pH d'une solution aqueuse d'acide fort ?
Il est possible de prévoir le pH d'une solution aqueuse d'acide fort.
➡️ En effet, si la concentration initiale de l'acide fort mélangé à l'eau est "C", alors la concentration des ions oxonium formés est aussi égale à "C".
Remarque : on suppose alors que cette concentration "C" est nettement supérieure à 10-7 mol.L-1 et par conséquent que les ions oxonium issus de la réaction d'autoprotolyse de l'eau peuvent être négligés.
Puisque [H3O+] = C alors pH = - log (C) avec C la concentration de l'acide fort dans l'eau.
Les bases fortes ⚗️

Définition d'une base forte ?
Une base est dite "forte" si sa réaction avec l'eau peut être considérée comme totale et qu'il ne subsiste alors en solution que son acide conjugué.
➡️ La réaction de cette base B- avec l'eau peut alors se traduire par l'écriture de l'équation bilan suivante :
B- + H2O → BH + OH-
La flèche dirigée vers la droite indique simplement que la réaction chimique ne se réalise que dans un seul sens.
Exemple ➡️
Un exemple de base forte couramment utilisée est l'hydroxyde de sodium (NaOH), également connu sous le nom de soude caustique. Le NaOH est un solide blanc qui, lorsqu'il est dissous dans l'eau, libère un grand nombre d'ions hydroxyde (OH-), ce qui en fait une base forte. On l'utilise notamment dans le processus de saponification à froid avec l'eau.
pH d'une solution aqueuse de base forte ?
Tout comme pour la solution aqueuse d'acide fort, il est également possible de prévoir le pH d'une solution aqueuse de base forte.
? En effet, si la concentration initiale de la base forte mélangée à l'eau est "C", alors la concentration des ions hydroxyde formés est aussi égale à "C".
Remarque : on suppose alors que cette concentration "C" est nettement supérieure à 10-7 mol.L-1 et que les ions hydroxyde issus de la réaction d'autoprotolyse de l'eau peuvent être négligés.
On sait que [OH-] = C
Or, Ke = [H3O+][OH-]
Donc  = \frac{Ke}{C}
= \frac{Ke}{C}
Comme pH = - log ([H3O+])
Alors 
En remplaçant Ke par sa valeur 10-14 pour une solution aqueuse à 25°C, on obtient alors la relation suivante :
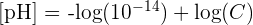
Soit pH = 14 + log(C) avec C la concentration de la base forte dans l'eau.
En bref, si le pH mesure l'acidité ou la basicité d'une solution, tandis que le pKa indique la force d'un acide, ces concepts sont bien plus riches qu'il n'y paraît ! Riches, mais également fondamentaux pour comprendre et prédire les réactions acido-basiques en chimie.
À présent, vous avez toutes les cartes en main : à vous de jouer !























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Trop Super ce cours, sa donne l’envie de tout apprendre
Comment savoir si une base ou un acide est fort(e) où faible.
Bonjour, avez-vous essayé de contacter l’un de nos professeurs pour recevoir une aide personnalisée ? Bonne journée ! 🙂
Votre est parfait. Je kiffe ça. C’est très bon
je voulais la classification des acides/bases fort(e)s, de force moyenne et faibles selon le pKa/pKb et le rapport entre le nombre de particules(basiques/acides) ayant réagi et le nombre de particules engagés
Merci beaucoup
SVP comment démontrer qu’une base est forte ou faible
Je recherchais une démonstration simple du pH d’une base forte en solution aqueuse. je viens de la trouver sur cettepage. Merci.
Comment peut vérifier que la réaction est totale