Chapitres
- 01. Absorption des rayonnements infrarouge par les composés organiques
- 02. Tracé d'un spectre infrarouge
- 03. Le rayonnement infrarouge
- 04. Identification des liaisons grâce à un spectre infrarouge
- 05. L'appareillage en spectrophotométrie infrarouge
- 06. Déroulement de l'analyse en spectroscopie infrarouge
- 07. Application industriel de la spectroscopie infrarouge

Absorption des rayonnements infrarouge par les composés organiques
Qu'est-ce qu'un spectre infrarouge ?
Le spectre infrarouge est obtenu après l'analyse d'une poudre, d'un liquide ou d'un gaz à la lumière infrarouge. Ils sont utilisés pour identifier les différents types de liaisons présentes dans les molécules organiques.
Contrairement à de nombreuses analyses qui ne peuvent être appliquées sur l'ensemble des molécules existantes, l'immense majorité des molécules sont analysables par spectrophotométrie infrarouge. C'est un des outils les plus utilisé pour la caractérisation des molécules, et une des méthodes les plus courantes dans l'industrie.
Principe de la spectrophotométrie infrarouge
Quel que soit l'état (solide, liquide ou gazeux), les atomes d'une molécule ont une certaines mobilité les uns par rapport aux autres : ils sont dotés de mouvements de vibrations qui modifient légèrement et périodiquement la longueur et l'orientation des liaisons. Il existe différents type de déformation des liaisons. Par exemple, pour les molécules possédants minimum 3 atomes, voici les principaux :
- Etirement symétrique : les deux atomes "extérieurs" s'éloignent et se rapprochent simultanément de l'atome central.
- Étirement asymétrique : quand l'un des atomes "extérieurs" se rapproche, l'autre s'éloigne de l'atome central.
- Cisaillement : les atomes "extérieurs" se rapprochent et s'éloigne l'un de l'autre dans le plan de la molécule.
- Torsion : un des atomes "extérieurs" se déplace d'avant en arrière du plan de la molécules, tandis que l'autre effectue le chemin inverse.
Les molécules organiques peuvent absorber des rayonnements infrarouge qui modifient l'état de vibration de leurs liaisons. La longueur d'onde de l'absorption de ces rayonnements dépend principalement de la nature des atomes liés, de la nature de la déformation et du type de liaison ( simple, double ou triple), mais aussi des liaisons voisines et du solvant utilisé. La loi de Beer-Lambert est toujours valable dans la région des infrarouges, cette méthode est donc également quantitative.
Tracé d'un spectre infrarouge

Afin de faciliter la comparaison des spectres de molécules issues de laboratoires et d'appareils différents, le spectre infrarouge obtenu représente souvent la transmittance en pourcentage en fonction du nombre d'ondes. En effet, l'utilisation de l'absorbance brute, entraînerait d'importantes variations d'intensités d'un appareil à l'autre rendant plus difficile l’existence de base de données communes.
L'axe des abscisses
Il comporte le nombre d'onde noté σ qui correspond à l'inverse de la longueur d'onde : 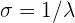
- avec λ en centimètres (cm)
- σ en centimètres moins un ( cm-1)
Par ailleurs cet axe est gradué de gauche à droite de manière décroissante.
L'axe des ordonnées
Il comporte la transmittance qui est une grandeur notée T, sans unité mais en général exprimée sous forme d'un pourcentage et définie par la relation : 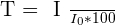
- I0 est l'intensité du rayonnement incident du spectroscope
- I est l'intensité du rayonnement après la traversée de la cuve du spectroscope
- T est exprimée en pourcentage
La transmittance exprime la proportion de rayonnement traversant la cuve sans être absorbée :
- Si pour une longueur d'onde donnée il n'y a pas d'absorption alors T = 100 %
- Si pour une longueur d'onde donnée un rayonnement est totalement absorbé alors T = 0 %
- Une absorption concerne en général non pas une longueur d'onde donnée mais un intervalle de longueur d'onde qui peut avoir une amplitude variable : le spectre comporte alors une " bande d'absorption " dirigée vers le bas.
Le rayonnement infrarouge
Les infrarouges correspondent à des rayonnements dont la longueur d'onde est comprise entre 800 nm et 1 mm, mais la spectroscopie IR ne fait en général appel qu'à ceux compris approximativement entre 2,5 μm et 25 μm ce qui correspond à un intervalle de nombre d'onde compris entre 400 et 4000 cm-1, appelés infrarouge moyens.
Il existe également des appareils utilisant le proche infrarouge, ne permettant cependant pas l'identification de molécule. Leurs utilisations ne sera pas détaillée ici.

Identification des liaisons grâce à un spectre infrarouge
Il est possible de distinguer deux zones différentes sur un spectre infrarouge :
- L'intervalle des nombres d'onde compris entre 400 et 1400 cm-1 comporte des pics et bandes d'absorption caractéristiques de l'espèce chimique analysée. Cette zone correspond à "l'empreinte digitale" de l'espèce chimique et permet de l'identifier à partir de spectres infrarouge connus.
- L'intervalle des nombres d'onde compris entre 1400 et 4000 cm-1 comporte les bandes d'absorption des différents types de liaison (avec cependant quelques exceptions pour des liaisons dont les bandes se situent en dessous de 1400 cm-1).
Les plages d'absorption des principales liaisons :
| Liaison | Plage d'absorption ( en cm^-1) |
|---|---|
| Entre un hydrogène et un carbone comportant uniquement des liaisons simples | 2850 - 2960 |
| Entre un hydrogène et un carbone comportant une double liaison | 3010 - 3100 |
| Entre un hydrogène et un carbone comportant un triple liaison | vers 3300 |
| Entre deux carbone triplement liés | 2100 - 2260 |
| Entre un carbone et un oxygène liés par une liaison simple | 1000 - 1300 |
| Entre un carbone et un oxygène liés par une double liaison | 1700 - 1750 |
| Entre un oxygène et un hydrogène | 3590 - 3650 |
La présence de liaisons hydrogènes (liaisons intermoléculaires que peut former l'hydrogène avec un oxygène, azote ou fluor par exemple), peut modifier certaines plages d'absorption. En effet, la liaison d'un hydrogène avec un oxygène d'une autre molécule entraîne une élongation de la liaison dans la molécule initiale. En conséquence, la fréquence de vibration de la liaison est affaiblie, et le nombre d'onde devient plus petit. Par exemple, la présence de liaisons hydrogènes sur des fonctions alcool va décaler le pic vers 3300 cm-1. Aussi le pic aura tendance à s'élargir car toutes les fonctions alcools ne possèdent pas de telles liaisons et donc vibrerons aux fréquences classiques. L'identification de molécule pourra se faire en étudiant les plages d'absorption, mais aussi (et surtout) grâce à l'utilisation de base de données de spectre de molécules connues.
L'appareillage en spectrophotométrie infrarouge
L'appareillage en spectrophotométrie infrarouge est relativement simple, compact et peu coûteux. Il nécessite :
- une lampe émettant un faisceaux de lumière infrarouge,
- une cellule réceptionnant l'échantillon,
- un interféromètre, permettant de s'affranchir d'un échantillon référence
- et un détecteur.
Le tout est relié à un ordinateur permettant le traitement du signal obtenu ainsi que le paramétrage de l'analyse.
Déroulement de l'analyse en spectroscopie infrarouge
L'analyse infrarouge est l'une des rares permettant l'analyse de composés dans les trois états, solides, liquides et gazeux :
- A l'état gazeux ne nécessite pas de préparation spécifique d'échantillons mais la cellule doit être large car les gaz n'absorbe pas beaucoup les rayons infrarouge (faible densité de molécules)
- A l'état liquide, dans les laboratoires d'analyse chimique, quelques gouttes de la solution sont placée entre deux pastilles de sels (chlorure de sodium, bromure de potassium) qui n'absorbent pas les rayons infrarouge. La pastille est ensuite placée dans l'appareil. Dans l'industrie agroalimentaire le liquide est directement pompé dans la cellule.
- A l'état solide, il existe plusieurs techniques dépendant du type d'appareil :
- Certains, permettent de directement déposer un film de poudre.
- D'autres imposent la formation d'une pastille. Pour ce faire, la poudre à analyser est mélangée avec un sel (les mêmes que ceux cités précédemment) puis comprimée à l'aide d'une presse hydraulique. La pastille est ensuite placée dans l'appareil.
- Enfin, dans les matières plastiques notamment, il est possible de découper un microfilm directement analysable. Ainsi, l'analyse peut conserver l'intégrité de l'échantillon
Si l'analyse infrarouge est très rapide, peu coûteuse, relativement peu gourmande en échantillon, cette analyse possède tout de même quelques limites. Par exemple, si le but est d'identifier une molécule, il est nécessaire que le produit analyser soit le plus pur possible, ce qui n'est pas toujours facile à obtenir, surtout dans des quantités suffisantes.
Application industriel de la spectroscopie infrarouge

Dans l'industrie chimique
Cette technique est très utilisée en laboratoire de contrôle qualité, pour le contrôle de la pureté du produit par exemple. Grâce à la miniaturisation des appareils et l'existence de sondes par fibres optiques, la spectrophotométrie est très utilisée dans l'industrie pour le contrôle de l'évolution de réaction chimique en direct (analyse en ligne). Ainsi les opérateurs peuvent s'assurer à tout moment du bon déroulé de la réaction chimique, ce qui permet d’arrêter le réacteur immédiatement si ce n'est pas le cas.
Dans l'industrie agroalimentaire
Si au départ les spectres infrarouge ont servi à analyser des molécules pures, voire quelques mélanges simples, vers la fin du siècle dernier, avec les progrès de l'informatique et les possibilités accrues de traitement statistiques des signaux obtenus, l'industrie agroalimentaire (lait, vins...) s'est emparée de la technologie. En effet, l'analyse complète de ses mélanges complexes de molécules (acides gras pour le lait, alcool, polyphénols, acides organiques, arômes pour le vin) nécessite un grand nombre de techniques différentes, et donc un temps d'analyse très long pour avoir une connaissance complète du produit. Ces délais n'étaient pas satisfaisants et ne favorisaient pas les échanges commerciaux. La spectrophotométrie infrarouge a intéressé les acteurs de ces industries par sa rapidité, et sa facilité de mise en oeuvre (appareils simples, compacts, peu coûteux, peu ou pas de préparation d'échantillon). L'interprétation du spectre n'a rien à voir avec l'analyse moléculaire, le mélange étant complexe, il est impossible d'associer un signal avec une molécule en particulier. Par contre, assez rapidement les chercheurs se sont rendu compte que certaines parties du signal étaient corrélées avec les résultats d'analyses classiques (par exemple, plus le pic est important, plus la concentration en cette molécules l'est aussi). Certaines corrélations sont moins évidentes et nécessites de manipuler mathématiquement le spectre infrarouge initiale. Les chimistes se sont fait aider de mathématiciens et statisticiens afin de rendre possible l'analyse de lait et de vin en quelques secondes par exemple. Bien-sûr, les résultats par ce type d'analyses ne font pas références, et les appareils doivent en permanence être étalonnés par rapport à l'analyse classique mais ils permettent une analyse de qualité suffisante pour les échanges commerciaux. Ainsi, les laboratoires d'analyse de vins sont passés d'une dizaine d'échantillons analysés par jours à quelques centaines. Cette évolution était indispensable pour permettre un contrôle qualité de la production viticole en temps réel lors de l'élaboration des vins juste après les vendanges. En effet, la période de récolte du raisin est très resserrée et tous les viticulteurs produisent leur vin à la même période (septembre-novembre). Les laboratoires doivent être maintenant capables de pouvoir absorber une telle masse de travail afin de répondre aux exigences de l'industrie du vin.























Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
Comment on peut détecter les diamants est-ce qu’il y a les appareils qui détectent le diamant dans les sous-sol
Pour moi la loi de béer Lambert n’est pas valable dans le cas de cette technique car la monochromatécite n’est pas respectée c’est logique ou non ? J’attends votre réponse monsieur
Bonjour, nous serions ravis de vous aider ! Avez-vous essayé de contacter l’un de nos professeurs ? Excellente journée ! 🙂
Bonjour
Comment peut on deferencié entre les réactifs et les produits de la réactin par infra -rouge ?
cc l’humidité est une géne majeure lors de la réalisation des spectre IR?? et pourquoi?
Je veux poser quelques questions :
1- Elaborer un protocole expérimental (principe de IR)
2- Comment expliquer la présence de « pics » sur les spectres IR
3- Interpréter les résultats obtenus
4-Identifier les produits inconnus
S’il vous plaît répondre bientôt, merci
Bonjour,
Nous ne faisons pas leurs devoirs à la place des élèves mais si vous avez besoin d’une aide personnalisée, vous pouvez contacter l’un de nos professeurs 🙂
Quelles sont les différents zone dans un spectre infrarouge qui etens de 4000 600cm
Comment on peut détecter les diamants est-ce qu’il y a les appareils qui détectent le diamant dans les sous-sol