Chapitres
- 01. Définition
- 02. Liste
- 03. Unité du numéro atomique
- 04. Numéro atomique et nombre de masse
- 05. Numéro atomique et masse atomique
- 06. Numéro atomique et nombre d'électrons
- 07. Numéro atomique dans un ion ou une molécule
- 08. Modification du numéro atomique : notion de fission et de fusion nucléaire
- 09. Le tableau périodique

Définition
L’atome est composé d’un noyau, lui-même composé de nucléons : les protons et les neutrons. Ces protons, de charge positive, sont dénombrés grâce au numéro atomique. Il s'agit donc de la grandeur qui caractérise, non pas chaque atome comme son nom pourrait le laisser penser, mais chaque élément chimique. Il se note Z et correspond au nombre de protons présents dans le noyau d'un élément. Il est caractéristique d’un élément chimique : si ce nombre change (par perte ou gain d’un proton par exemple), l’élément chimique change. C’est le principe des réactions nucléaires. Exemples :
- Le numéro atomique de l'or Au est de 79 car il y a 79 protons dans les atomes et les ions d'or
- Le numéro atomique de l'oxygène O est de 8 car il y a 8 protons dans les atomes et les ions d’oxygène
Liste
Voici un tableau reprenant la correspondance entre le nom de l’élément et le numéro atomique de l’élément, tel que retrouvé dans le tableau périodique. Les éléments sont classés par ordre alphabétique.
| Nom de l'élément | Numéro atomique | Nom de l'élément | Numéro atomique |
|---|---|---|---|
| Actinium | 89 | Molybdène | 42 |
| Aluminium | 13 | Neodym | 60 |
| Americium | 95 | Néon | 10 |
| Antimoine | 51 | Neptunium | 93 |
| Argent | 47 | Nickel | 28 |
| Argon | 18 | Niobium | 41 |
| Arsenic | 33 | Nobelium | 102 |
| Astate | 85 | Osmium | 76 |
| Azote | 7 | Or | 79 |
| Baryum | 56 | Oxygène | 8 |
| Berkelium | 97 | Palladium | 46 |
| Berryllium | 4 | Phosphore | 15 |
| Bismuth | 83 | Platine | 78 |
| Bohrium | 107 | Plomb | 82 |
| Bore | 5 | Plutonium | 94 |
| Brome | 35 | Polonium | 84 |
| Cadmium | 48 | Potassium | 19 |
| Calcium | 20 | Praséodyme | 59 |
| Californium | 98 | Promethium | 61 |
| Carbone | 6 | Protactinium | 91 |
| Ceryum | 58 | Radium | 88 |
| Césium | 55 | Radon | 86 |
| Chlore | 17 | Rhenium | 75 |
| Chrome | 24 | Rhodium | 45 |
| Cobalt | 27 | Rubidium | 37 |
| Cuivre | 29 | Ruthenium | 44 |
| Curium | 96 | Rutherfordium | 104 |
| Darmstadtium | 110 | Samarium | 62 |
| Dubnium | 105 | Scandium | 21 |
| Dysprosium | 66 | Seaborgium | 106 |
| Einsteinium | 99 | Sélénium | 34 |
| Erbium | 68 | Silicium | 14 |
| Etain | 50 | Sodium | 11 |
| Europium | 63 | Strontium | 38 |
| Fer | 26 | Soufre | 16 |
| Fermium | 100 | Tantale | 73 |
| Fluor | 9 | Technetium | 43 |
| Francium | 87 | Tellure | 52 |
| Gadolinium | 64 | Terbium | 65 |
| Gallium | 31 | Thallium | 81 |
| Germanium | 32 | Thorium | 90 |
| Hafnium | 72 | Thulium | 69 |
| Hassium | 108 | Titane | 22 |
| Hélium | 2 | Tungstène | 74 |
| Holmium | 67 | Ununbium | 112 |
| Hydrogène | 1 | Ununhexium | 116 |
| Indium | 49 | Ununoctium | 118 |
| Iode | 53 | Ununpentium | 115 |
| Iridium | 77 | Ununquadium | 114 |
| Krypton | 36 | Ununseptium | 117 |
| Lanthane | 57 | Ununtrium | 113 |
| Lawrencium | 103 | Urunium | 111 |
| Lithium | 3 | Uranium | 92 |
| Lutétium | 71 | Vanadium | 23 |
| Magnésium | 12 | Xénon | 54 |
| Manganèse | 25 | Ytterbium | 70 |
| Meitnerium | 109 | Yttrium | 39 |
| Mendelevium | 101 | Zinc | 30 |
| Mercure | 80 | Zirconium | 40 |
Unité du numéro atomique
Le numéro atomique n'a pas d'unité ! En effet ce n'est pas une grandeur physique mais un nombre, en l’occurrence un nombre de protons : par conséquent on ne lui attribue pas d'unité. Cela est également vrai pour le nombre de masse A et le nombre de neutrons N.
Numéro atomique et nombre de masse
Lorsque le numéro atomique (Z) et le nombre de masse (A) d'un élément sont connus, il est possible de décrire entièrement la composition de son noyau et sa configuration électronique :
- Z indique le nombre de protons et, par souci de neutralité électrique de l’atome, au nombre d’électrons. Attention, on parle bien ici d’un atome, et non pas d’un électron.
- A correspond au nombre de nucléons présents au total dans le noyau
- N = A – Z correspond au nombre de neutrons
La cohésion du noyau résulte de l’équilibre entre la force nucléaire forte (qui attire les nucléons entre eux) et la force électromagnétique (répulsion entre les protons). Ce sont ces forces qui permettent de stabiliser un noyau. La plupart des isotopes stables d'un élément (avec un noyau possédant le même Z mais un N différent entre les noyaux) ont un nombre de neutrons très proche ou égal au nombre de protons (Z proche ou égal à N). Par conséquent, le nombre de masse A possède souvent une valeur proche du double de Z (A = 2 x Z) mais cette tendance est surtout vérifiée pour les éléments légers. Pour les éléments plus lourds, N tend à devenir inférieur à Z. Il existe plusieurs formes possibles d'un nucléide :
- des isotopes : deux atomes isotopes possèdent le même nombre de protons (donc un même Z), mais le nombre de neutrons varie
- des isotones : deux atomes isotones possèdent le même nombre de neutrons (même N), mais le nombre de neutrons varie
- des isobares : deux atomes isobares possèdent le même nombre de masse (même A). Si N augmente, Z diminue d'autant.
- des isomères : deux atomes isomères possèdent les mêmes A, Z, et N, mais l'état d'excitation des atomes varie.
Numéro atomique et masse atomique
Lorsqu'on connait seulement le numéro atomique d'un atome, il n'est pas possible de déterminer sa masse atomique car celle-ci ne peut être obtenue que si l'on connait la composition complète du noyau. Or Z n'indique que le nombre de protons. Le noyau comporte aussi des neutrons dont il faut tenir compte pour calculer la masse atomique. L’essentiel de la masse d’un atome est concentrée dans le noyau. Cependant, la masse d’un noyau est inférieure à la somme des masses des nucléons avant constitution du noyau : il existe un défaut de masse, due à l’énergie de liaison totale du noyau, qui diminue la masse totale du noyau. [M_{noyau}=Ztimes M_{protons}+Ntimes M_{neutrons}-triangle m] La somme des constituants isolés de chaque noyau sera donc supérieure à celle du noyau à la composition équivalente, à cause de ce défaut de masse. [E=triangle mtimes c^{2}] Dans cette formule, le défaut de masse ∆m est exprimé en u.m.a., soit « unité de masse atomique », unité basée sur la masse d’un atome de carbone 12 de façon à ce que cet atome ait une masse de 12 u.m.a. La masse d’un nucléon est proche de 1 u.m.a. L’équivalent énergétique du défaut de masse E est équivalente à l’énergie de liaison totale du noyau B, et c correspond à la célérité de la lumière dans le vide. On peut exprimer E en MeV avec l’équivalence : 1 u.m.a x c2 = 931,5 MeV.
Numéro atomique et nombre d'électrons
Un atome étant par définition neutre, son nombre d'électrons (portant chacun une charge -e) est égal au nombre de protons (portant chacun une charge +e) : le numéro atomique Z correspond donc aussi bien au nombre de protons qu’au nombre d’électrons. Dans le cas des ions ceci n'est plus vrai, il faut déterminer le nombre d'électrons perdus ou gagnés lors de la formation de l'ion pour trouver le nombre total d'électrons. Il est possible pour cela :
- d'utiliser la formule de l'ion (lorsqu'elle est connue) : un ion Ca2+ aura par exemple perdu 2 électrons par rapport à l’élément Ca, alors qu’un ion Cl- aura gagné un électron par rapport à l’élément Cl
- d'établir la structure électronique de l'atome afin d'utiliser la règle du duet ou de l'octet pour prévoir le nombre d'électrons perdus ou gagnés (afin de réaliser la règle de l’octet ou du duet)
Numéro atomique dans un ion ou une molécule
Un élément chimique peut se présenter sous forme atomique ou ionique, dans un corps simple ou composé. Mais chacune de ces formes n'affecte pas le noyau : par conséquent, un élément conserve le même nombre de protons et donc le même numéro atomique. L’élément hydrogène conserve par exemple le numéro atomique Z=1 qu'il soit sous forme d'ion hydrogène (H+), sous forme de dihydrogène (H2) ou sous forme d'eau (H2O). Cette conservation du numéro atomique est au cœur même de la notion d'élément chimique.
Modification du numéro atomique : notion de fission et de fusion nucléaire
La stabilité d’un noyau atomique est définie selon plusieurs critères visibles d’après la courbe d’Aston. Cette courbe permet d’effectuer un lien entre l’énergie de liaison moyenne par nucléon B/A (exprimé en MeV) et le nombre de nucléons dans le noyau. 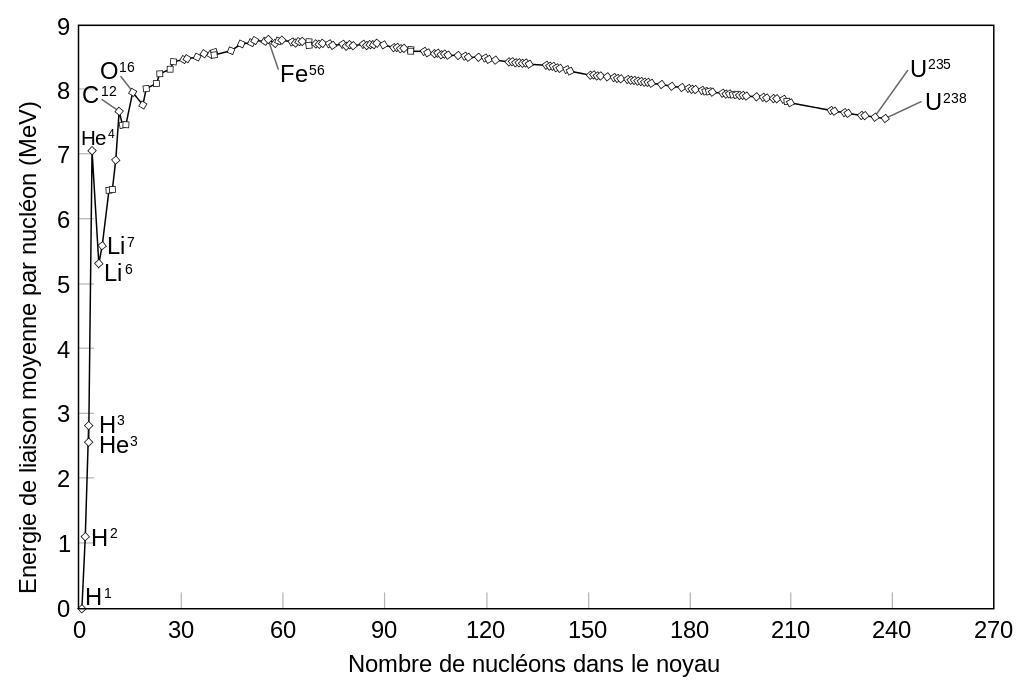
- La fusion nucléaire : elle se déroule entre deux noyaux légers, et nécessite un apport d’énergie supérieur à B/A
- La fission nucléaire : elle concerne un noyau lourd, et libère une partie de l’énergie de liaison B du noyau. Elle peut être contrôlée, dans un réacteur nucléaire, ou en chaine, dans une bombe atomique.
Dans les deux cas, les réactions modifient le numéro atomique Z initial de l’atome, et va donc produire un nouvel élément chimique.
La fusion nucléaire
Au cours d’une fusion nucléaire, deux noyaux atomiques légers s’assemblent, à l’aide d’un apport d’énergie thermique, pour former un noyau plus lourd. Cette fusion a pour effet l’émission de particules α et de neutrons. C’est ce phénomène que l’on retrouve dans la bombe H, ou bombe à hydrogène, théoriquement 1000 fois plus puissantes que les bombes lâchées sur Hiroshima ou Nagasaki durant la Seconde guerre mondiale.
La fission nucléaire
Dans un réacteur nucléaire, la réaction de fission est obtenue par bombardement des noyaux d’uranium 235U par des neutrons. Ce noyau d’uranium est naturellement instable. Les bombardements libèrent l’énergie correspondant au défaut de masse sous forme d’énergie cinétique et de photons, ainsi que 2 noyaux ayant un nombre de masse A de l’ordre de 100 à 140.
Le tableau périodique
Le tableau périodique a permis d’ordonner les éléments selon leur numéro atomique, qui correspond approximativement à leur masse atomique. Les différentes versions du tableau périodique comportent un nombre variable d'informations pour chaque élément, mais elles fournissent obligatoirement leur numéro atomique. S'il n'y a qu'une valeur indiquée dans le cadre d'un élément, c'est forcément lui ! Dans la plupart des classifications périodiques, le numéro atomique est accompagné du nombre de masse (A), mais il est facile de les distinguer car le numéro atomique est toujours plus petit que le nombre de masse. Pour plus d’informations sur le sujet, voir le cours sur « Le tableau de Mendeleiev ».






















Si vous désirez une aide personnalisée, contactez dès maintenant l’un de nos professeurs !
j’aime beaucoup se cite
J’aime souvant se cours de chimie pas que sans chimie sa la vie…
Comment vérifier la masse du sulfate de sodium deçà hydraté qui est M=322g/mol
Le numéro atomique d’un ion Z ne correspond pas au nombre d’électron
Comment sont formés les éléments dont le numéro atomique va au delà de celui du Fer?
L’ion Mg2+ a 10 électrons. Quel est son numéro atomique ?
bonjour quelle atome a 21 prontons, 24 neutrons et 21 électrons